Тимъти Дж. ЛаРока
От ‡ Катедра по основни и социални науки, Колеж по фармация и здравни науки Олбани, Олбани, Ню Йорк 12208,
Сергей А. Сосунов
§ Департамент по педиатрия, Колумбийския университет, Ню Йорк, Ню Йорк 10032, и
Никол Л. Шакърли
От ‡ Департамент по основни и социални науки, Олбански колеж по фармация и здравни науки, Олбани, Ню Йорк 12208,
Вадим С. Десет
§ Департамент по педиатрия, Колумбийския университет, Ню Йорк, Ню Йорк 10032, и
Адам Дж. Ратнер
§ Департамент по педиатрия, Колумбийския университет, Ню Йорк, Ню Йорк 10032, и
катедрите по ¶ Педиатрия и
‖ Микробиология, Нюйоркски университет, Ню Йорк, Ню Йорк 10016
Резюме
Въведение
Некроптозата е възпалителна програмирана клетъчна смърт (PCD) 2, различна от апоптозата (1, 2). Некроптозата води до исхемично-реперфузионно увреждане на мозъка, бъбреците и сърцето, така че фармакологичното инхибиране на този PCD намалява размера на инфаркта при модели на тези наранявания (3, 4). Този PCD е независим от апоптозата и каспазите (1, 2). Добре проучени некроптотични стимули са лиганди от семейството TNF, включително TNF-α, Fas лиганд (FasL) и TNF-подобен апоптоза-индуциращ лиганд (TRAIL), в контекста на инхибиране на пан-каспаза със Z-VAD-fmk (1, 2, 4). Наскоро беше показано, че некроптозата се появява в ануклеатни червени кръвни клетки (RBC) в отговор на специфичните за човешкия CD59 (hCD59) бактериални порообразуващи токсини (PFT), вагинолизин (VLY) и интермедилизин (ILY) (5, 6). Този PCD зависи от фосфорилирането на RIP1 и RIP3 киназите (1, 5, 6). Взаимодействието на RIP1 с RIP3 е необходимо за повечето форми на некроптоза, което води до цитозолен некрозомен комплекс, който включва също Fas-асоцииран домен на смъртта (FADD), каспаза-8 и протеин, подобен на киназен домен от смесена линия (MLKL) (1, 2). В рамките на този комплекс RIP1, RIP3 и MLKL задвижват сигнала надолу по веригата при некроптоза, водеща до клетъчна смърт (2).
Ефекторните пътища надолу по веригата на некрозомата, които са отговорни за клетъчната смърт, включват образуването на напреднали крайни продукти за гликиране (AGEs) и реактивни кислородни видове (ROS) (1, 7). Образуването на AGE и ROS зависи от гликолизата (8), която се увеличава по време на некроптоза (1). AGEs се образуват поради синтеза на токсичното производно, метилглиоксал, от фрагментацията на глицералдехид фосфат и дихидроксиацетон фосфат по време на гликолиза (8, 9). Производството на ROS се дължи предимно на преждевременното освобождаване на частично редуциран кислород от електронната транспортна верига на окислителното фосфорилиране (10). Друг основен източник на ROS е NADPH оксидазното семейство протеини, които са с широко тъканно разпределение (11). Тъй като окислителното фосфорилиране и образуването на НАДФН зависят от метаболизма на глюкозата (10), гликолизата се разглежда като регулатор на производството на АФК.
Хипергликемията и диабетът водят до увеличаване на клетъчното усвояване на глюкоза (12). Тъй като стимулацията на гликолизата е основен ефектор на некроптозата (1, 7), това предполага, че този PCD може да бъде засилен от хипергликемия. Тук показваме, че излагането на хипергликемични нива на глюкоза предразполага първични еритроцити, Jurkat Т клетки и U937 моноцити за RIP1-зависима некроптоза, което води до значително подобряване на този PCD in vitro. Показано е, че RIP1 е критичен за това чрез фармакологично инхибиране и RNAi. Гликолизата и AGEs са важни за това засилване на некроптозата във всички клетъчни типове, докато ROS и повишените нива на протеин на RIP1, RIP3 и MLKL участват в усилването на некроптозата в ядрените клетки. Хипергликемичното грундиране на PCD е специфично за некроптозата, тъй като нито ериптозата, нито външната апоптоза не се засилват. Мозъчните инфаркти, индуцирани от нараняване с хипоксия-исхемия (HI), имат значително по-голям размер в условията на хипергликемия при мишки. Обострянето на мозъчните инфаркти беше напълно предотвратено чрез инхибиране на RIP1 in vivo. Тези резултати показват безпрецедентна биохимична връзка между хипергликемия, гликолиза и засилена RIP1-зависима некроптоза.
Експериментални процедури
Клетки и бактериални щамове
Първичните човешки еритроцити са получени от здрави доброволци по протокол, одобрен от Институционалния съвет за преглед на университета в Колумбия. U937 моноцити и Jurkat Т клетки се култивират в RPMI с 10% фетален говежди серум при 37 ° C, 5% CO2.
Анализи на хемолиза
Рекомбинантните PFT се пречистват, както е описано по-горе (5, 6, 33). Тестовете за хемолиза се провеждат в PBS на Dulbecco при 37 ° С за 30 минути, като се използват 0,1 хемолитични единици VLY или ILY. За това 1 хемолитична единица се определя като количеството PFT, необходимо за предизвикване на 50% хемолиза на червените кръвни клетки, изложени на 5 m m глюкоза, както е описано по-горе (5). Червените кръвни клетки бяха предварително инкубирани в PBS на Dulbecco, съдържащи посочените количества глюкоза в продължение на 24 часа при 37 ° C, за да се предизвика усвояване. Червените кръвни клетки се измиват с PBS на Dulbecco без глюкоза преди експерименти. Инхибиторите се инкубират с еритроцити в продължение на 1 час при 37 ° C преди тестове за хемолиза и се използват при тези концентрации: nec-1s (EMD Millipore, 50 μ m), пиридоксамин (Acros Organics, 0,5 mm), дезипрамин (Tocris, 20 μ m ) и 2,2-бипиридил (Alfa Aesar, 50 μ m). Хиперосмотична и индуцирана от калций ериптоза се индуцират чрез инкубация на червените кръвни клетки с 950 m m захароза или 1 m m CaCl2, съответно, за 24 h при 37 ° C. Хемолизата беше измерена чрез освобождаване на хемоглобина в спектрофотометър при 415 nm.
Тестове за клетъчна смърт
Рекомбинантен човешки TNF-α (Life Technologies) и FasL (Enzo Life Sciences) бяха използвани при посочените LD50 дози в присъствието на 0,5 μg/ml циклохексимид. Тестовете за клетъчна смърт се провеждат в RPMI при 37 ° С, 5% CO2 за 24 часа с клетки при 5 × 10 5/ml. Клетките бяха предварително инкубирани в RPMI, съдържащи посочените количества глюкоза в продължение на 24 часа, за да се предизвика усвояване. Клетките се промиват с нормален RPMI преди експерименти. За експерименти, които използват натриев пируват, 5 m m се добавят към клетките и се оставят да се инкубират в продължение на 24 часа. Инхибиторите се инкубират с клетки в продължение на 1 час преди тестове за смърт и се използват при тези концентрации: nec-1s (EMD Millipore, 25 μ m), Z-VAD-fmk (Takara, 10 μ m), пиридоксамин (Acros Organics, 0,5 mm ), дезипрамин (Tocris, 20 μ m) и бутилиран хидроксианизол (Sigma, 10 μ m). Клетъчната смърт е измерена чрез WST-1 анализ (Roche Applied Science).
Имунопреципитации
RIP1 се имунопреципитира от RBC ултразвуци с 10 μg anti-RIP mAb (клон G322-2, BD Biosciences) за една нощ при 4 ° С. Протеинови G Plus-агарозни зърна (Pierce) бяха добавени за 2 h при стайна температура. Имунопреципитатите се промиват, суспендират се в 1 × NuPAGE LDS буфер (Invitrogen), варят се и се пускат на SDS-PAGE, последвано от прехвърляне в PVDF. Обработките с VLY и ILY се извършват с 0,5 хемолитична единица от всеки PFT за 30 минути при 37 ° C преди имунопреципитация.
Имуноблоти
RBC лизатите са получени чрез обработка с ултразвук на 5% RBC. Лизатите от U937 и Jurkat клетки са получени чрез третиране на 4 × 10 7 клетки в лизисен буфер (20 mm Tris, 150 mm NaCl, 1 mm EDTA, 1 mm EGTA, 1% Triton X-100, pH 7.5) върху лед за 30 мин. Лизатът се изчиства от ядрен материал чрез центрофугиране в продължение на 15 минути при 4 ° С. Клетките се третират с 20 ng/ml TNF-a за 2 h или 100 ng/ml FasL за 5.5 h с Z-VAD-fmk. Лизатите се изследват върху имуноблот от mAbs срещу следните протеини: RIP1, RIP3 (Cell Signaling Technology), MLKL (Cell Signaling Technology), хемоглобин (Thermo Scientific) и GAPDH (Cell Signaling Technology). Петната са разработени с помощта на хемилуминесценция. За откриване на фосфорилиран RIP1 (p-RIP1), заешко mAb срещу фосфор-Ser/Thr (100G7E, клетъчна сигнална технология) е използвано за откриване на p-RIP1 в имунопреципитати, както е описано по-горе (5, 6).
U937 моноцити бяха трансфектирани с контрол или siRNA срещу RIP1 (Life Technologies) с помощта на векторния комплект за плик GenomeONE-Neo EX HVJ (Axxora) съгласно инструкциите на производителя.
Количествена PCR
РНК беше извлечена с помощта на комплект за пречистване на GeneJET RNA (Thermo) съгласно инструкциите на производителя. РНК се определя количествено чрез спектрофотометрия. Количествената PCR е направена с термоциклер Applied Biosystems StepOne Plus, като се използва Path-ID Multiplex RT-PCR комплект в една стъпка (Life Technologies) и TaqMan Gene Expression Assays (Applied Biosystems) съгласно инструкциите на производителя. Концентрацията на РНК се нормализира до 200 ng за всяка реакция. Специфични сонди TaqMan (Приложни биосистеми) бяха: RIPK1 (Hs00169407_m1 FAM-MGB), RIPK3 (Hs01011177_g1 FAM-MGB) и MLKL (Hs04188508_m1 FAM-MGB). Реакциите бяха проведени в три екземпляра и относителното количествено определяне на експресията беше определено след нормализиране с ендогенен контрол GAPDH (Hs03929097_g1VIC-MGB). Промяна в сгъването е установена с помощта на ΔΔCT метод за анализ.
In Vivo Мозъчен модел на хипоксия-исхемия
Статистика
Статистическият анализ беше извършен с помощта на GraphPad Prism. За всички in vitro анализи на смърт и количествена PCR е използван двупосочен дисперсионен анализ с дисперсионния тест Bonferroni. Еднопосочен анализ на дисперсионния тест с последващ анализ на Fisher беше използван за определяне на разликата в обема на мозъчния инфаркт и нивата на глюкоза in vivo. Всички резултати са от 3 или повече независими експеримента.
Резултати
Некроптозата на червените кръвни клетки, индуцирана от специфични за човека бактериални PFT, се засилва след излагане на хипергликемични нива на глюкоза
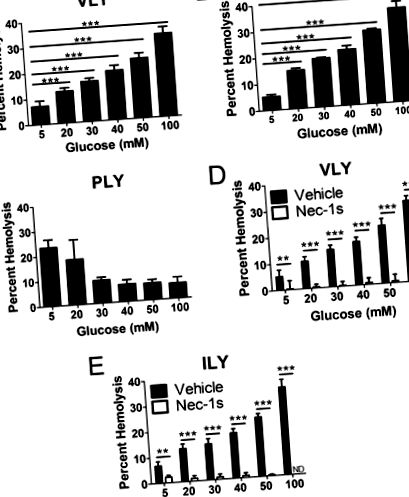
За да тестваме хипотезата, че високите нива на глюкозните първични клетки за некроптоза, първо използвахме модела на некроптоза на червените кръвни клетки, който дефинирахме по-рано (5, 6). Некроптозата на червените кръвни клетки се индуцира от VLY или ILY и се измерва за първични червени кръвни клетки, предварително изложени на концентрации на глюкоза, вариращи от 5 до 100 m m. Смъртта на червените кръвни клетки от VLY или ILY се увеличава в зависимост от дозата по отношение на различните нива на глюкоза (фиг. 1, А и В). Смъртта на червените кръвни клетки от независимия от hCD59 PFT, пневмолизин, който не причинява некроптоза на червените кръвни клетки (5, 6), не се засилва от излагане на високи нива на глюкоза (фиг. 1 С), а по-скоро се инхибира, в съответствие с предишни резултати върху осмотичната хемолиза (13, 14). Увеличението на смъртта на червените кръвни клетки от VLY и ILY в резултат на излагане на високи нива на глюкоза се дължи на усилена некроптоза на червените кръвни клетки, тъй като инхибирането на RIP1 с некростатин-1s (nec-1s) (4) го предотвратява (Фиг. 1, D и E ).
Излагането на високи нива на глюкоза подлага човешки еритроцити за некроптоза in vitro. Анализи на хемолиза, показващи, че смъртта на червените кръвни клетки, стимулирана от 0,1 хемолитична единица на hCD59-специфичните PFT (A) VLY и (B) ILY, се засилва след лечение с нарастващи количества глюкоза. С, анализ на хемолизата, показващ, че високите нива на глюкоза не повишават смъртта на червените кръвни клетки от независимия от hCD59 PFT, пневмолизин (PLY). Повишената хемолиза, причинена от hCD59-специфичните PFT (D) VLY и (E) ILY след излагане на високи нива на глюкоза, е напълно предотвратена чрез инхибиране на RIP1 с nec-1s. Превозно средство = DMSO. **, p Фиг. 2, A и B). Гликолизата е от решаващо значение за увеличаването на некроптозата на червените кръвни клетки, тъй като излагането на високи нива на неметаболизираща 2-деоксиглюкоза няма ефект върху смъртта (фиг. 2, С и D). Производството на AGEs и ROS след RIP1 зависи от гликолизата (1, 5) и наистина, усилването на некроптозата на RBC чрез глюкоза зависи от AGEs (фиг. 2, E и F). Генерирането на церамид от киселинна сфингомиелиназа (aSMase), която не е свързана с гликолиза или зависими от желязо ROS са важни и за некроптозата на червените кръвни клетки. Въпреки че инхибирането на тези ефектори води до леко инхибиране на смъртта на червените кръвни клетки (фиг. 2, G – J), то не инхибира напълно засилената смърт на червените кръвни клетки при хипергликемични условия, каквито се наблюдават при инхибиране на AGEs (фиг. 2, E и F) . Следователно изглежда, че тези ефектори играят малка, ако има такава, роля в хипергликемичното усилване на некроптозата на червените кръвни клетки.
Хипергликемичното грундиране на червените кръвни клетки за некроптоза зависи от гликолизата и AGEs. A, имуноблот анализ на лизати от еритроцити, предварително инкубирани в 5 или 50 m m глюкоза (5, 50) и стимулирани с VLY или ILY. Нивата на RIP1 не се променят при хипергликемични условия (50) спрямо нормалната глюкоза (5). В, имуноблоти от RIP1 имунопреципитации (IP), показващи, че RIP1 фосфорилирането (p-RIP1) не се променя при хипергликемични условия. C и D, анализи на хемолиза на червените кръвни клетки, показващи, че лечението с 2-дезоксиглюкоза няма ефект върху смъртта на червените кръвни клетки от VLY или ILY. E и F, засилената хемолиза от VLY или ILY след излагане на високи нива на глюкоза се предотвратява чрез инхибиране на образуването на AGE с пиридоксамин. G и H, инхибиране на зависимата от желязо ROS с 2,2-бипиридил; или I и J, aSMase с дезипрамин (DPA) инхибира леко некроптозата на червените кръвни клетки, но не предотвратява некроптозата, подсилена от хипергликемия, до нивото на инхибиране на AGE. Veh = превозно средство. *, p 2+ намалява след лечение с високи нива на глюкоза (фиг. 3) в съответствие с предишна работа, показваща, че изчерпването на глюкозата подобрява този PCD (16). Това показва, че хипергликемичното първоначално смърт на червените кръвни клетки е специфично за некроптозата.
Грундирането на смъртта на червените кръвни клетки чрез хипергликемични условия не засилва ериптозата. A, ериптотичната смърт, причинена от хиперосмотичен стрес (osm) или излишък на калций (cal), не се засилва след излагане на високи нива на глюкоза. В, ериптозата намалява след лечение с високи нива на глюкоза, както се определя чрез инхибиране на ериптотичната сигнализация чрез p38 MAP киназа. Двупосочен дисперсионен анализ с диференциален тест Bonferroni, **, p m (11,1 m m), над физиологичната норма от 5 m m. Следователно, за да тестваме ефекта на нивата на глюкоза, еквивалентни на критичните хипергликемични нива (25 m m), използвахме пет пъти това количество (50 m m) и го сравнихме с ефекта на нормалната среда. Некроптозата се предизвиква от TNF-α или FasL в контекста на инхибиране на пан-каспаза със Z-VAD-fmk (1, 4). Излагането на високи нива на глюкоза повишава клетъчната смърт при няколко различни литични дози TNF-α или FasL и при двата клетъчни типа (Фиг. 4, А и В). Повишената смърт беше потвърдена като RIP1-зависима некроптоза, тъй като беше инхибирана от nec-1s (Фиг. 4, С и D). Освен това, инхибирането на RIP1 със специфична siRNA (фиг. 4 Д) напълно предотвратява засилената смърт на U937 клетки (фиг. 4 F). Тези резултати показват, че високи нива на глюкоза U937 моноцити и Jurkat Т клетки за некроптоза.
- Как да унищожим системата за стареене на мастните клетки
- ОПЛ трябва рутинно да претеглят пациентите, чиито състояния са свързани със затлъстяването, за да се избягват; фалиране;
- Картина на черния дроб (анатомия), функция, състояния, тестове, лечения
- IJMS Безплатен пълен текст NAD метаболомен анализ в човешки клетки с помощта на 1H NMR спектроскопия
- Въздействие на затлъстяването върху клетките на костния мозък предоставя нови идеи за начина на живот и биологията -