Пола Раваско
1 Университетска болница в Санта Мария, 1649-035 Лисабон, Португалия; [email protected]
2 Университет в Лисабон, 1649-028 Лисабон, Португалия
3 Център за интердисциплинарни изследвания в здравеопазването (CIIS) на португалския католически университет, 1649-023 Лисабон, Португалия
Резюме
1. Въведение
Въз основа на тази рамка беше извършено търсене на литература в PubMed и Cochrane Library от самото начало до 26 март. Търсенето се състои от термини: рак, хранене, хранителна терапия, недохранване, кахексия, саркопения, оцеляване, хранителни вещества, насоки. Ключовите думи бяха свързани чрез използване на „ИЛИ“ като булева функция и резултатите от четирите компонента бяха комбинирани чрез използване на булева функция „И“. Избрани са насоки, клинични изпитвания и наблюдателни проучвания, написани на английски език. В тази статия са упоменати семинарни документи в района, дори ако са датирани извън времевата линия за търсене, както е подходящо.
2. Резултати
2.1. Хранителен скрининг и оценка
Скринингът за хранителен риск възможно най-рано позволява да се идентифицират пациентите с риск от недохранване [25]. Скринингът трябва да се направи възможно най-рано, а съвременната литература предполага, че трябва да се направи при диагностициране или при постъпване в болница; скринингът трябва да се повтори в хода на лечението за насочване за оценка, ако е необходимо [19,21,23,25,26,27]. Доказателствата подкрепят интегрирането на скрининга за недохранване в грижите за пациенти с рак. Адекватният инструмент за скрининг на недохранване трябва да бъде кратък и лесен за запълване, евтин, силно чувствителен и с добра специфичност [25]. MUST (Malnutrition Universal Screening Tool) и NRS-2002 (Nutritional Risk Screening-2002) се считат за подходящи [28,29,30]; MNA (Mini Nutritional Assessment) е подходящ инструмент за хранителна оценка при възрастните хора [19,23].
Когато има хранителен риск, скринингът трябва да бъде последван от цялостна хранителна оценка, за да се определи по-добре хода на хранителната намеса. Изглежда, че няма консенсус относно най-добрия метод за извършване на тази оценка, но SGA (Субективна глобална оценка) и PG-SGA (Генерирана от пациент-субективна глобална оценка) са валидирани за хранителна оценка на възрастни онкологични пациенти [25,26,31 ].
Когато се използва изолирано, загубата на тегло е неефективна за откриване на недохранване, тъй като има ниска чувствителност към метаболитни промени, които се случват при пациенти с рак. И все пак ранната и редовна оценка, съчетана с оценката на хранителния прием, ИТМ и възпалителния статус е стандартна клинична препоръка [19,26]. Що се отнася до ИТМ, той има ниска чувствителност за откриване на промени в хранителния статус, особено при пациенти със затлъстяване, поради което той трябва да се използва само в комбинация с други инструменти за оценка [26,32].
Съставът на тялото предоставя ценна информация при лечението на пациенти с рак, тъй като методите за образна диагностика откриват загуба на мускулна маса, както и инфилтрация на мастни мускули [2]. При пациенти с рак, изложени на риск от недохранване, саркопения и кахексия, трябва да се направи оценка на мускулната маса [19,21]. Наличните методи са двойна рентгенова абсорбциометрия (DEXA), компютърна томография на нивото на 3-ти прешлен или анализ на биоимпеданса (BIA). Освен това се препоръчва да се извършва хранителна оценка за етапите на ракова кахексия, тъй като хранителната намеса е най-ефективна в етапите на прекахексия и кахексия [13].
2.2. Хранителна намеса
За справяне с хранителното влошаване, събирането на обективни данни за хранителния статус и развитието му по време на протичането на заболяването е от първостепенно значение. Различните видове рак или места показват различни хранителни модели, които изискват персонализирана хранителна терапия. Хранителното влошаване е многофакторен краен резултат, определен от свързаните с рака фактори и фактори, свързани с храненето и/или метаболизма. Правилното хранене може да облекчи тежестта на симптомите, да подобри здравето в целия континуум на рака, да подкрепи преживяемостта от рак [33,34,35,36] и е отличителен белег за успешното лечение на рака.
Хранителните интервенции ще варират в зависимост от медицинската история на пациентите, вида и стадия на рака, както и от отговора на лечението. Ако пациентът може да се храни и има функционален стомашно-чревен тракт, консултациите по хранене, със или без ONS, трябва да бъдат избраната намеса за справяне с променените хранителни нужди поради лечение или заболяване [19,21,26]. Може да се наложи ONS, като средство за компенсиране на по-ниския прием на храна и за да се опита да предотврати влошаване на храненето по време на лечението. Мониторингът на спазването на избраната хранителна интервенция е от съществено значение.
2.2.1. Индивидуално хранително консултиране
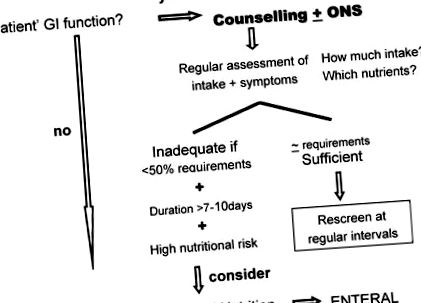
В клиничната практика храненето през устата винаги е приоритет. Храненето през устата е предпочитаният начин на хранене, тъй като е значителна част от ежедневието на пациента и допринася значително за автономността на пациентите [19]. Представлява привилегировано време за прекарване със семейството и приятелите, избягвайки тенденцията за изолация. Признанието, че предписаната диета е индивидуализирана, адаптирана и адекватна на индивидуалните нужди, дава на пациента усещане за контрол, поради което е и много ефективен подход за психологическа модулация. Всички тези фактори могат потенциално да допринесат за подобряване на качеството на живот на пациентите и могат да модулират острата и късната заболеваемост. Препращането към специалист по хранене, отговорен за индивидуалното диетично консултиране, винаги трябва да се основава на планове за вземане на решения (Фигура 1).
План за вземане на решения, основан на доказателства.
Като клиницисти трябва да признаем измеренията, които са определящи за пациентите. Всъщност диетата е единственият фактор, който пациентът чувства, че може да контролира по време на целия курс на лечение и интервенции. Също така, адекватният прием на храна се признава от пациента, както и от семейството и болногледачите, като от съществено значение за поддържане на ежедневната активност, енергия, функционален капацитет и за по-успешно преодоляване на лечението. По-специално, хранителното разхищение е често срещано, независимо от раковия стадий (лечебен, адювантен, до палиативен) и е независим предиктор за лоша физическа функция, по-ниско качество на живот, хирургични усложнения и намалена преживяемост [3,10,13,37]. Пропиляването на рак се характеризира с влошаване на мускулната маса, което се наблюдава при повече от 50% от новодиагностицираните пациенти с рак, в сравнение с 15% разпространение при здрави индивиди на подобна възраст [38]. Тъй като мускулната маса и мастната тъкан играят роля в онкологичните резултати, стратегиите за оптимизиране на телесния състав са важна част от успешната терапия на рака. Следователно, основна цел на хранителната интервенция е да повлияе благоприятно на телесния състав, с потенциал за подобряване на резултатите от терапията на рака, заболеваемостта и в крайна сметка прогнозата.
За да бъде ефективно, индивидуализираното консултиране трябва да се основава на задълбочена оценка на различни хранителни и клинични параметри: хранителен статус и хранителен прием, обичайна диета, непоносимост или неприязън към храна, психологически статус на пациентите, автономност, сътрудничество, нужда от помощ или подкрепа на други в акта на хранене. Изчерпателна оценка на симптомите също е задължителна (Таблица 1).
маса 1
Чести причини за лош прием на хранителни вещества при пациенти с рак.
Влошаване на вкуса, миризмата и апетита, като последица от тумора и/или терапията
Променени хранителни предпочитания/избягване на храна/отвращение от храна
Проблеми с храненето (зъби, дъвчене)
Дисфагия, одинофагия или частична/тотална стомашно-чревна обструкция
Ранно засищане, гадене и повръщане
Болезненост, ксеростомия, лепкава слюнка, болезнено гърло, тризъм
Орални лезии и езофагит
Мукозит, предизвикан от лъчетерапия/химиотерапия
Остър или хроничен лъчев ентерит по време и след лъчетерапия
Ако/когато пероралното хранене е недостатъчно/недостатъчно, трябва да се обмисли изкуствено хранене [19,20,21,23,26,27]. Критериите за ескалация на хранителните мерки са: (1) недостатъчен прием на храна (1,0 g/kg/ден протеин. Следователно, за да се поддържа протеинов баланс, до 1,5 g/kg/ден или повече протеин е съгласието. В хранителните добавки PN, основен АА трябва да присъстват в около 50% от АА, а АА с разклонена верига трябва да съставляват останалите 50% от общия АА [50]. Що се отнася до мазнините като енергиен субстрат, най-съгласуваните режими имат отчитане на мазнините за ≈50% от протеиновите калории [51,52].
Наскоро PN като допълнителен път на приложение на хранителни вещества (SHPN) се появи като възможен ресурс за оптимизиране на доставката на хранителни вещества. Проспективните проучвания [53,54,55,56,57] на SHPN предполагат възможна полза от енергийния баланс, увеличените телесни мазнини, по-голям капацитет за упражнения и QoL. Неотдавнашно рандомизирано проучване показа, че SHPN може да предотврати загуба на ММ при пациенти с нелечим рак на стомашно-чревния тракт [57]. Следователно все още няма достатъчно доказателства за препоръчване на SHPN при пациенти с рак за подобряване на QoL и хранителните параметри. Освен това практиката на HPN се различава в различните страни; повечето не обмислят използването на PN, ако има функционален стомашно-чревен тракт, докато други могат да обмислят използването му, ако е в съответствие с волята на пациента [58,59,60].
Синдром на повторно хранене може да възникне, когато се наблюдават тежки промени в течностите и електролитите при силно недохранени пациенти, получаващи EN или PN, и той може да причини хипофосфатемия, хипокалиемия, хипомагнезиемия, дефицит на тиамин, промени в баланса на натрий, глюкоза и течности, както и в метаболизма на протеини и липиди [ 19,21]. Неговата профилактика се препоръчва, когато ИТМ 2 или при неволна загуба на тегло> 15% през последните три до шест месеца или когато има малко или никакъв хранителен прием за повече от 10 дни или ако има намалени нива на калий, фосфат или магнезий преди хранене. Ако настъпи сериозно намаляване на приема на храна в продължение на поне пет дни, се препоръчва постепенно увеличаване на храненето в продължение на няколко дни и не трябва да се осигуряват повече от 50% от изчислените енергийни нужди през първите два дни на хранене [19, 25]. Идентифицираните дисбаланси на течности и електролити трябва да бъдат коригирани, а обемът на кръвообращението, балансът на течностите, сърдечната честота и ритъм, както и клиничното състояние, трябва да се наблюдават внимателно. Понастоящем вниманието към риска от синдром на повторно хранене се разглежда в насоки за лечение на рак [19,20,21,22,23,26,27].
2.2.3. Хирургия
За да се сведе до минимум реакцията на метаболитен стрес и катаболизмът, свързани с операция при недохранени пациенти, програмата за засилено възстановяване след операция (ERAS) се препоръчва за всички пациенти с рак, подложени на лечебна или палиативна хирургия [18,22,61]. В рамките на протокола ERAS трябва да се следват следните принципи: Скрининг за недохранване и да се осигури допълнителна хранителна подкрепа, ако е необходимо [18,22]; избягвайте предоперативното гладуване; трябва да се има предвид предоперативното лечение с въглехидрати, както и възстановяването на орално хранене през първия следоперативен ден; и ранна мобилизация [18,22]. За да се избегне предоперативно гладуване, пациентите без риск от аспирация имат право да ядат твърда храна до шест часа и да пият бистри течности до два часа преди анестезия [18].
При онкологични хирургични пациенти с умерен до тежък хранителен риск се препоръчва хранителна подкрепа преди и след операцията [18,25]. Ако е налице тежко недохранване, може да се наложи отлагане на операцията [18,25]. Когато се подлага на тежка операция, хранителната подкрепа трябва да се предоставя рутинно, като се обръща особено внимание на пациенти в напреднала възраст с саркопения.
Освен протокола ERAS, ранното стартиране на хранителни добавки може значително да намали степента на загуба на тегло и честотата на усложнения [22,25]. Ако се очаква, че след операцията пациентът няма да може да яде повече от седем дни, препоръчва се започване на хранителна терапия дори при добре подхранени пациенти [18,22,25]. След операцията, оралното хранене също трябва да се предпочита пред EN, а последното да се предпочита пред PN. Ако е възможен прием през устата, той трябва да започне след операция без прекъсване, след оценка на индивидуалната поносимост. Ако пероралното хранене не е възможно, EN трябва да се започне в рамките на 24 часа, като се предпочитат стандартни полимерни ентерални формули, ако са подходящи [25].
2.2.4. Лъчетерапия и химиотерапия
Устният мукозит, дисфагия и диария са често срещани усложнения на лечението с RT и/или CT [12,13,14,15,16,17,18,19,20,21,22]. По време на RT също се препоръчват хранителни консултации, особено при HNC, рак на гръдния кош и стомашно-чревния тракт [12,13,14,15,16,17,18,19,20,21,22,23]. Когато се счете за необходимо, трябва да се осигури ONS [62], а когато е налице тежък мукозит, трябва да се обмисли изкуствено хранене [23]. Когато диетичните консултации и ONS са недостатъчни за намаляване на загубата на тегло или при наличие на тежък мукозит или обструктивни тумори на главата или шията или гръдния кош, трябва да се обмисли изкуствено хранене [19,20,23]. При пациенти, лекувани с RT или химиорадиотерапия, PN не се препоръчва [19] и трябва да се има предвид само когато адекватното хранене не може да бъде осигурено с орално или EN [19].
2.3. Специфични хранителни вещества
Хранителните стратегии, които потенциално позволяват по-добро управление на рака, са широко изследвани, но малцина са постигнали убедителни резултати.
2.3.1. Протеин
Много пациенти с рак не отговарят на препоръчания прием (1,2–1,5 g/kg/ден), нито дори този за здрави индивиди (0,8 g/kg/ден) [63]. Ограниченият прием на протеини произтича главно от симптомите на въздействието на храненето, които влияят върху приема на диети [64]. Последните насоки предполагат по-висок обхват на прием на протеини (1,2–1,5 g/kg/ден), поради положителните резултати от по-високия прием на протеини при балансиране на протеините и при поддържане на мускулната маса. Допълнителен интерес представлява скорошно проучване, показващо обратна връзка между консумацията на червено месо и седемгодишната смъртност сред 992 индивида с рак на дебелото черво в стадий III [65], което предполага, че по-високият прием на протеини всъщност може да бъде от полза при рак.
Интервенциите с аминокиселини са тествани при рак, с цел оптимизиране на хранителния статус и противодействие на загубата на мускулна маса. Те включват добавки с аминокиселини с разклонена верига (левцин, изолевцин и валин) [63], β-хидрокси β-метил бутират, карнитин и креатин. И все пак са необходими допълнителни изследвания, за да се изяснят потенциалните ползи.
Що се отнася до глутамина, неговото добавяне в случаи на орален мукозит или за предотвратяване/лечение на диария по време на RT на таза не се препоръчва [19,22,26]. Що се отнася до употребата му, когато PN се изисква при пациенти, подложени на трансплантация на хематопоетични стволови клетки, насоките не са идентични: има справедлива степенувана препоръка за евентуална употреба от 0,2–0,5 g/kg/ден [26] и индикацията, че няма достатъчно доказателства, за да се препоръча за или срещу глутамин, за да се намалят страничните ефекти на противораковата терапия, особено при протоколи с високи дози [19]. Що се отнася до потенциала му за подобряване на мускулната маса, няма достатъчно данни, които да го подкрепят.
2.3.2. Ейкозапентаенова киселина и рибено масло
За изясняване на клиничните ползи са необходими опити с хомогенни популации пациенти по отношение на типа рак, стадия, антинеопластичните схеми, дозировката на добавките и начина на приложение. Всъщност, заслужава да се отбележи, че с оглед на умерените ползи за оцеляване от CT/RT при някои видове рак, важни въпроси за лекарите са оптимизирането на благосъстоянието, качеството на живот чрез хранителен статус и адекватен телесен състав [70].
2.3.3. Микроелементи
Поради неблагоприятните ефекти на терапията и ограничената диета на много пациенти, Американският институт за изследване на рака [71], Американското общество по рака [72] и Европейското общество за клинично хранене и метаболизъм — ESPEN [19] подкрепят използването на мултивитамини -мултиминерална добавка в дози, близки до препоръчителната хранителна добавка. Високите дози витамини и минерали не се препоръчват при липса на специфични недостатъци [19,20]. Недостигът на витамин D може да бъде от значение при рак [19]; също така се съобщава за връзка между ниско съдържание на витамин D и загуба на мускулна маса. В резултат на това може да е необходим витамин D, за да се оптимизира ефективността на протеиновите добавки. В светлината на скорошната литература добавянето на витамин D с 600–800 международни единици (RDA) при пациенти с рак може да бъде от полза в контекста на предотвратяване на загуба на мускулна маса, но са необходими допълнителни изследвания.
3. Дискусия
Основният хранителен проблем при рака е загубата на мускулна маса, призната за предиктор за по-ниско качество на живот, нарушена функционалност, хирургични усложнения и съкратена преживяемост [10,63,73,74]. Трябва да се отбележи, че саркопенията се проявява независимо от загуба на тегло или мастна маса. По този начин, клинично значим фенотип, който също се появи при рак, се характеризира със саркопения с прекомерна мастна маса. Освен това, към предишните проучвания, демонстриращи основното въздействие на изчерпването на мускулната маса върху преживяемостта и токсичността на лечението [73,74], скорошно проучване в кохорта пациенти с рак на главата на врата, показа, че пациентите с кахексия са имали по-лошо оцеляване без заболяване в сравнение с некахектични пациенти [12,39].
Имайки това предвид, клиничните усилия и приоритет, дадени за подобряване на резултатите от лечението, логично ще трябва да включват хранителна намеса и адекватност на телесния състав. Търсенето на ефективна хранителна интервенция, която подобрява телесния състав (запазване на мускулната маса и качеството на мускулите) е от първостепенно значение за клиницистите и пациентите, предвид последиците за прогнозата. Ранното откриване на недохранване и кахексия трябва да бъде част от мултимодален подход за подобряване както на центрираните към пациента, така и на онкологичните резултати [47].
4. Заключения
Конфликт на интереси
Авторите не декларират конфликт на интереси.
- Новата готварска книга има за цел да помогне на пациенти с рак по време на лечение и възстановяване
- Новото лъчелечение предоставя възможности за пациенти с рак на простатата UPMC Pinnacle
- Новият микроРНК биомаркер може да помогне за откриване на метастази в лимфните възли при пациенти с рак на панкреаса;
- Предоперативна хранителна подкрепа при пациенти с рак без клинични признаци на
- Оптимизиране на грижите за злокачествена обструкция на червата при пациенти с напреднал гинекологичен рак JCO