Резюме
лептинът е хормон, получен от мастна тъкан, за който се предполага, че е сигнал за отрицателна обратна връзка при регулирането на енергийния баланс (46). Централното (12, 43) или периферното (37) приложение на лептин инхибира приема на храна на гризачи с нормално тегло и коригира много аспекти на синдрома на затлъстяването при мишки с дефицит на лептин ob/ob (20, 33). Отрицателният енергиен баланс, свързан с лечението с периферен лептин, води до специфична загуба на телесна мастна маса и поддържане на чиста телесна маса (20); за разлика от това, централното приложение на лептин може да доведе до загуба както на мазнини, така и на чиста тъкан (5). Въпреки че лептинът е ефективен регулатор на енергийния баланс при гризачи с нормално тегло, затлъстелите или възрастните животни имат високи циркулиращи концентрации на ендогенен лептин, но са устойчиви на лептин, тъй като приложението на лептин не влияе върху приема на храна или телесното тегло (7, 9, 44, 45 ).
Ранните наблюдения, че периферната лептинова резистентност предшества развитието на централна лептинова резистентност при мишки с високо съдържание на мазнини (9), доведоха до заключението, че периферната лептинова резистентност е резултат от неуспеха на лептина да премине кръвно-мозъчната бариера (1), докато централната лептиновата резистентност е неуспех на лептина да активира своите рецептори (38). В съответствие с тези наблюдения, лептиновата резистентност при индуцирани от диета плъхове със затлъстяване е свързана с неуспех в активирането на хипоталамусните рецептори, докато рецепторите на задния мозък остават лептинови (25). Други (29) обаче съобщават, че лептиновите рецептори само в специфични области на хипоталамуса не реагират при резистентни към лептин диети, предизвикани от затлъстели мишки, което предполага, че резистентността е свързана с промени в чувствителността на рецепторите, а не с транспорта на лептин през кръвта -мозъчна бариера.
Данните от CD плъховете ни доведоха до допълнителна хипотеза, че при нестимулирани условия лептиновите рецептори, разположени в задния мозък и/или периферията, антагонизират катаболния ефект на лептиновата активност в предния мозък. Целта на изследванията, описани тук, е да се тества дали рецепторите за преден и заден мозък лептин имат различен ефект върху телесния състав. Това беше постигнато чрез хронично вливане на ниски дози лептин в 3-та или 4-та камера на плъхове или чрез вливане на плъхове периферно с лептин, като същевременно инхибира активирането на рецепторите на предния мозък или задния мозък чрез вливане на лептиновия антагонист на лептиновия протеин мутеин (мутеин) ( 42) в 3-та или 4-та камера.
МЕТОДИ
Плъховете, използвани в тези проучвания, са мъжки плъхове Sprague-Dawley (Harlan Laboratories, Indianapolis, IN), настанени с включени светлини в продължение на 12 часа всеки ден от 0700. Те са настанени индивидуално в клетки с телена мрежа. Всички животни имаха свободен достъп до чау (LabDiet 5012; PMI Nutrition International, Brentwood, MO) и вода, освен ако не е посочено друго. Всеки плъх имаше клетка Nylabone (Nylabone Products, Neptune, NJ) в клетката си за обогатяване. Всички процедури за животни са одобрени от институционалните комитети за използване на грижите за животните към Университета в Джорджия и Университета по здравни науки в Джорджия.
Експеримент 1: ефект от инфузия на лептин с ниска доза от 4-та камера.
На 12-ия ден от инфузията, храната беше отстранена от клетките на плъховете в 7:00 ч. Сутринта. Започвайки в 10:00 ч. Сутринта, плъховете бяха убити и бе събрана кръв от багажника за измерване на серумния лептин (комплект Rat Leptin RIA, Millipore). Ингвинална, епидидимална, ретроперитонеална и мезентериална бяла мазнина и IBAT бяха дисектирани, претеглени и върнати в трупа. Мазнината на трупа се определя, както е описано по-рано (15).
Допълнителни 14 плъхове бяха снабдени с помпи Alzet за доставяне или на PBS, или на 0,6 μg лептин/24 h в 4-та камера. В края на 5-дневната инфузия два плъха на група са били лишени от храна от 7:00 ч. До 12:00 ч. На обяд, преди да бъдат перфузирани с хепаринизиран физиологичен разтвор, последван от 4% параформалдехид. Мозъците се събират и се оставят в 4% параформалдехид за една нощ и след това се съхраняват в разтвор на захароза азид. Направени са коронални 30-μm разрези и хипоталамусният и мозъчният ствол фосфорилиран сигнален преобразувател и активатор на транскрипция-3 (pSTAT3) е открит чрез имунохистохимия, както е описано по-горе (14). Останалите 10 плъха (5 на група) са били лишени от храна от 7:00 до 11:00 ч. И са събрани тъканни блокове на хипоталамуса или мозъчния ствол за измерване на фосфорилирана STAT3, фосфоинозитид 3-киназа (pPI3K p85), извънклетъчна свързани кинази 1/2 (pERK1, pERK2) и AMP-активирана протеин киназа (pAMPK), супресор на цитокиновата сигнализация 3 (SOCS3) и протеин-тирозин фосфатаза (PTP1B) чрез Western blot, както е описано по-горе (17). Всички първични антитела са получени от Cell Signaling Technology (Danvers, MA), с изключение на анти-PTP1B, което е получено от Abcam (ab2009; Abcam, Cambridge, MA).
Експеримент 2: ефект от инфузиите на лептин с ниски дози от трета камера.
Резултатите от експеримент 1 показват, че плъховете, получаващи инфузии на лептин с 4-те вентрикули с ниска доза, натрупват телесни мазнини през 12-дневната инфузия на лептин. Това проучване е проведено, за да потвърди, че вливанията на лептин с ниски дози в 3-та вентрикула водят до загуба на тегло. Двадесет и осем плъха бяха снабдени с 3-камерна канюла, както е описано по-горе (6). Координатите за поставяне на канюла по средната линия на равен череп спрямо брегмата бяха предно-задна -2,8 mm, странична 0,0 mm и вентрална-9,0 mm. Изходните приема на храна и телесното тегло бяха измерени в продължение на 5 дни, започвайки 1 седмица след операцията. Плъховете са тежали 320-350 g в началото на изследването. В края на изходния период плъховете бяха разделени на четири групи, съответстващи на теглото, и към канюлата беше прикрепена помпа Alzet (модел 1002), доставяща PBS или 0,3, 0,6 или 0,9 μg лептин/ден. Взема се кръвна проба от опашката на ден 3 от инфузията за измерване на серумния лептин. Състав на тялото и серумен инсулин (инсулин за плъх RIA, Millipore), глюкоза, глицерол (свободен глицеринов реагент F6428; Sigma-Aldrich), свободни мастни киселини (FFA; NEFA C комплект, Wako Chemicals, Richmond, VA) и триглицериди (TG ) са измерени след 12 дни инфузия. Съдържанието на липиди в черния дроб и гликоген също се измерва, както е описано по-горе (16).
Експеримент 3: ефект на мутеина на 4-та камера и инфузия на периферен лептин.
Експеримент 4: ефект на мутеина от трета камера и инфузията на периферен лептин.
Според нашата хипотеза рецепторите за лептин на предния мозък антагонизират отговорите, произведени от рецепторите за лептин на задния мозък; следователно, това проучване тества дали блокадата на лептиновите рецептори за трета камера ще доведе до увеличаване на телесната мастна маса при плъхове, получаващи периферни инфузии на лептин. Седемдесет и два плъха бяха снабдени с канюла на 3-та вентрикула и позволиха 1 седмица да се възстанови от операцията. В края на 5-дневния изходен прием на храна и измерванията на телесното тегло, плъховете бяха разделени на осем групи, съответстващи на теглото, а останалата част от експерименталния протокол беше същата като за експеримент 3. Допълнително бяха монтирани два плъха на група за лечение с канюли и помпи Alzet, както е описано по-горе. След 5 дни инфузия, плъховете се упояват с кетамин и се перфузират за имунохистохимично откриване на pSTAT3.
Експеримент 5: диетичен модел на индуцирано от лептин затлъстяване.
Анализ на данни.
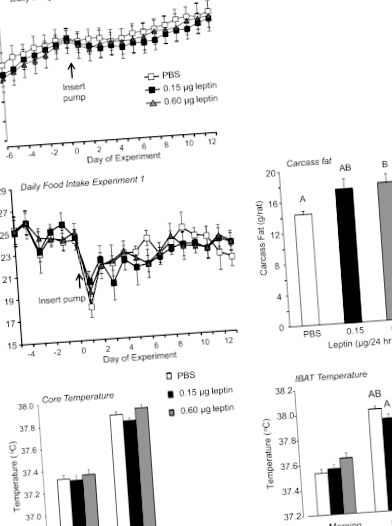
Статистически значимите разлики между лечебните групи бяха определени с помощта на софтуера Statistica версия 9.0 (StatSoft, Tulsa, OK). Разликите се считат за значими при P Фиг. 1). IBAT и основната температура, измерени чрез iButtons, бяха осреднени за 3 часа сутринта (8: 30–11: 30 ч.), Когато температурите бяха най-ниските за деня и 3 часа през нощта (7: 30–10: 30 ч.) ), когато температурите бяха най-високи през всеки от последните 9 дни от експеримента. След това средните стойности за всеки плъх бяха осреднени за всяка група. Нямаше значим ефект на лептина върху сутрешния IBAT (P Фиг. 1). Подобен модел е налице и при температурите в сърцевината, но разликата не достига значимост (P Фиг. 1). Въпреки че теглото на всички измервани депа на мазнини обикновено е по-високо при плъхове, инфузирани с 0,6 μg лептин/ден, отколкото при контролите, тези разлики не достигат значимост (данните не са показани). Серумният лептин, измерен в края на проучването, не се различава между групите (данните не са показани).
Ежедневно телесно тегло, дневен прием на храна, съдържание на мазнини в трупа, основна температура и интраскапуларна кафява мазнина (IBAT) температура на плъхове в експеримент 1. Данните са средно ± SE за групи от 11 или 12 плъхове, получаващи инфузии на PBS от четвърта камера или лептин за 12 дни.
Измерването на лептинови сигнализиращи протеини в хипоталамусната и мозъчната стволова тъкан след 5-дневна инфузия на 0,6 μg лептин/ден не показва промени във фосфорилирането на STAT3, PI3K или ERK1/2 в мозъчния ствол (фиг. 2); нито експресията на PTP1B не е увеличена. SOCS3 не е открит на нива, които могат да бъдат надеждно количествено определени. Изненадващо, инфузията на лептин в 4-та камера причинява малко, но значително увеличение на pPI3K в хипоталамусната тъкан. Активирането на STAT3 в хипоталамуса показва относително голяма вариация между отделните животни във всяка група на лечение и въпреки че има тенденция инфузията на лептин от 4-та камера да увеличи pSTAT3, това не е статистически значимо (Фиг. 2). Липсата на значително активиране на STAT3 в ядрото на самотния тракт (NTS) и дъгообразното ядро на хипоталамуса (ARC) на плъхове, получаващи инфузии на четвърти вентрикул на лептин, също се потвърждава от имунохистохимията (фиг. 3). Тъй като нивата на активиране са били ниски при плъховете, които са получавали инфузии на 4-та камера или PBS, или лептин от помпи Alzet в продължение на 5 дни, тъкан от плъх, който е получил ip инжекция от 1 mg/kg лептин 30 минути преди събирането на тъкани на фиг. 3 като положителен контрол за чувствителността на откриването на pSTAT3.
Western blot анализ на фосфорилиране (p) на лептинови сигнализиращи протеини STAT3, PI3K и ERK1/2 и експресия на SOCS3 и PTP1B в хипоталамусната и мозъчната стволова тъкан на плъхове, получаващи инфузии на 4-та камера на PBS или 0,6 μg лептин/ден в продължение на 5 дни. Данните са средно ± SE за 5 плъха.
Имунохистохимично откриване на pSTAT3 в ядрото на самотния тракт (NTS) и дъгообразното ядро (ARC) на хипоталамуса при плъхове, получаващи инфузии на 4-та камера на PBS или 0,6 μg/ден лептин за 5 дни или ip инжекция от 1 mg/kg лептин като положителен контрол. Изображенията на ARC или NTS са от един и същ плъх за определена група за лечение. AP, област postrema; CC, централен канал; SolM, медиално ядро на самотния тракт; 3-ти V, 3-ти вентрикул; ArcM, медиален ARC на хипоталамуса; ME, медиално извисяване. Изображенията са коригирани за контраст и яркост след заснемане.
Експеримент 2.
В този експеримент всички плъхове, получаващи инфузии на 3-те вентрикули с ниски дози лептин, отслабват и ядат по-малко през 12-те дни от експерименталния период в сравнение с контролите им (Фиг. 4). Загубата на тегло е комбинация от мазнини и постна тъкан (фиг. 4). Лептинът намалява размера на всички претеглени депа за мазнини, въпреки че ретроперитонеалната мазнина от плъхове, инфузирани с 0,6 или 0,9 μg лептин/ден, не е значително по-малка от тази от контролите (Таблица 1). Запасите от енергия на черния дроб също бяха значително изчерпани, като теглото на черния дроб, липидите и гликогена бяха по-ниски в инфузията на лептин от контролните плъхове (Таблица 1). Серумният лептин е намален с ~ 50%, а серумният инсулин с до 80% при плъхове, инфузирани с лептин, в сравнение с контролите, но няма ефект на лептин върху FFA, TG или глицерол (данните не са показани).
- Как да увеличим чистата телесна маса 13 стъпки (със снимки) - wikiHow Health
- Как да увеличим съдържанието на фибри в мъфин с трици за здравословно хранене SF Gate
- Как да увеличим чистата телесна маса 13 стъпки (със снимки) - wikiHow Health
- Как да увеличим телесното тегло за 7 дни стилове в живота
- Как да получите тяло като Дженифър Лопес - Хейли Помрой Хранителни съвети