Катедра по клетъчна биология и молекулярна медицина, Rutgers Medical School, Newark, NJ
Катедра по клетъчна биология и молекулярна медицина, Rutgers Medical School, Newark, NJ
* Кореспонденция на: д-р Джуничи Садошима, д-р, Институт за сърдечно-съдови изследвания, Биомедицински и здравни науки на Rutgers, 185 S Orange Ave, MSB G609, Newark, NJ 07103. E-mail:
Катедра по клетъчна биология и молекулярна медицина, Rutgers Medical School, Newark, NJ
Резюме
Може би едно от най-добре проучените сърдечни заболявания, причинени от дисрегулация на механизмите за контрол на качеството на протеините, е свързаната с десмин кардиомиопатия (DRM). DRM се причинява от дефицит или мутация на десмин, специфична за мускулите междинна нишка от тип III, която служи като скеле за свързване на саркомера с други вътреклетъчни структури. 5 αB ‐ кристалин (протеин на топлинен шок [HSP] B5) е малък HSP, който се свързва с десмин и е изобилен в сърдечните и скелетните мускули. Мутациите в αB-кристалин причиняват различни мускулни нарушения, включително хипертрофична и дилатационна кардиомиопатия и скелетна миопатия, характеризиращи се с образуването на неразтворими протеинови агрегати, състоящи се от αB-кристалин, протеини и неправилно локализиран десмин и последващо нарушаване на структурата на саркомера. 6
В настоящия брой на Вестник на Американската сърдечна асоциация (ЯХА), Ma et al демонстрират, че периодичното гладуване (IF) спасява напредналия кардиомиопатичен фенотип на трансгенни мишки със сърдечно-специфична експресия на човешки R120G αB-кристалин (CryABR120G), добре утвърден миши модел на DRM. 7 Въпреки че няколко интервенции, които имат за цел да подобрят контрола на качеството на протеините в сърцето, включително повишаване на регулирането на шаперони и автофагия, са показали, че подобряват сърдечната функция в този модел на мишка, 8 изследването, проведено от Ma et al 7, дава полезни допълнителни идеи за това как лечение за DRM трябва да бъде проектиран, което бихме искали да подчертаем по-долу.
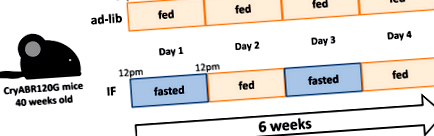
АКО включва редуващи се цикли на хранене и гладуване (Фигура 1) придоби популярност поради потенциалните си благоприятни ефекти върху здравето. 9 Авторите по-рано са забелязали, че ако транскрипционно IF регулира гени, кодиращи машината за автофагия-лизозома и стимулира автофагичния поток, за да подготви сърцето, намалявайки нараняването от исхемия и реперфузия и клетъчната смърт. 10 Ma et al 7 разшириха това наблюдение за лечение на усъвършенствана форма на DRM и демонстрираха, че IF спасява нарушения автофагичен поток, намалява протеиновите агрегати и подобрява сърдечната функция при мишки CryABR120G. Фактът, че IF е в състояние да подобри сърдечния фенотип на тази установена и тежка форма на DRM е клинично обещаващ.
Фигура 1. Протокол за хранене с периодично гладуване (IF), използван в проучване от Ma et al. 7 Възрастни мишки са настанени върху кедър/една постелка и са хранени с чау (Lab Diet 5053). В групата IF мишките се хранят през ден от 12 до 12 ч. В продължение на 6 седмици. След 6 седмици телесното тегло и кумулативният калориен прием са били значително по-ниски в IF групата, отколкото в групата ad-lib. CryABR120G показва R120G αB-кристалин.
Механично, Ma et al показват, че IF предизвиква ядрена локализация на транскрипционен фактор EB (TFEB), ключов транскрипционен фактор, който регулира автофагията и лизозомните машини, 7 и че TFEB директно индуцира транскрипционно повишаване на регулацията на HSPB8, малък HSP (Фигура 2). TFEB и HSPB8 активират както общата автофагия, така и подпомаганата от шаперон селективна автофагия, 11, 12, като по този начин премахват протеиновите агрегати и увредените органели, включително митохондриите. HSPB8 също така насърчава повторното сгъване на протеини като част от комплекса 13 на BAG3-HSPB8-HSC70 (BAG, B-клетъчен лимфом 2-свързан антиханоген; HSC, сроден на топлинен шок) 13 и подпомага възстановяването на десмина до неговата физиологична локализация. По-важното е, че проучването показва първите доказателства, че както TFEB, така и HSPB8 са необходими за медииране на оздравителния ефект на IF при мишки CryABR120G. 7
Фигура 2. Молекулярни механизми, чрез които интермитентното гладуване (IF) подобрява сърдечния фенотип при R120G αB-кристалин (Cry ABR 120G) мишки. IF деактивира целта на рапамицин при бозайници (mTOR) и предизвиква ядрена транслокация на транскрипционен фактор EB (TFEB), основен регулатор на биогенезата на лизозомите и автофагията. Оздравителният ефект на IF е критично медииран от TFEB. TFEB не само активира автофагията, като по този начин елиминира протеиновите агрегати и увредените митохондрии, но и транскрипционно усилва регулацията на протеина на топлинен шок (HSP) B 8, което от своя страна нормализира локализацията на десмина. HSPB 8 също стимулира автофагията чрез подпомагана от шаперон селективна автофагия и други неизвестни механизми. Автофагичното разграждане на протеиновите агрегати освобождава десмина, попаднал вътре, който от своя страна се връща към Z-линии и интеркалирани дискове с помощта на HSPB 8 и позволява възстановяване на нормалната структура на саркомера. Въпреки че проучването на Ma et al 7 ясно показва, че оздравителните ефекти на TFEB при мишки Cry ABR 120G са критично медиирани чрез HSPB 8, дали стимулацията на аутофагия е необходима, остава да се изясни.
IF подобрява инсулиновата резистентност при захарен диабет тип 14 и намалява възпалението и високото кръвно налягане. 15, 16 IF също е показано, че увеличава продължителността на живота на плъхове и мишки. 17 По този начин, въпреки че TFEB може да защити кардиомиоцитите с свръхекспресия на CryABR120G по автономно клетъчен начин, 7 оздравителният ефект на IF при мишки CryABR120G може да бъде медииран отчасти и чрез екстракардиални механизми.
Въпреки че се предполага, че механизмите на разграждане на протеини се индуцират в присъствието на неправилно сгънати протеини, механизмите, които поддържат качеството на протеините и органелите, очевидно са нарушени или недостатъчни в напреднали стадии на дисфункция при мишки CryABR120G. Нарушение на системата убиквитин-протеазома се наблюдава в трансгенни сърца на мишки CryABR120G, дори преди мишките да развият сърдечна дисфункция, 19 и автофагичната активност също е намалена по време на късния стадий на сърдечна дисфункция. 8 Изясняването на молекулярните механизми, предотвратяващи активирането на механизмите за контрол на качеството, е важно. Ma et al 7 предполагат, че целта на бозайниците за активиране на рапамицин, причинена от освобождаването на аминокиселини от първоначалното разграждане на неправилно сгънати протеини, инхибира ядрения внос на TFEB. Не е ясно обаче дали целта на активиране на рапамицин при бозайници е устойчива, тъй като автофагията се инхибира в напреднал стадий на DRM. Необходими са допълнителни изследвания, за да се изяснят сигналните механизми, контролиращи контрола на качеството на протеините в DRM.
Все повече доказателства показват, че IF може да подобри други сърдечно-съдови състояния, включително хипертония и индуцирана от стареене сърдечна хипертрофия. Проучването на Ma et al 7 предполага, че може да е възможно да се приложи IF за лечение на установени сърдечни заболявания, като кардиомиопатия и сърдечна недостатъчност. Проучването също така предполага, че може да е възможно да се разработи интервенция за активиране на TFEB или регулиране на HSPB8 в сърцето за лечение на DRM като алтернатива на IF. Подобно на миметиците за ограничаване на калориите, интервенциите, имитиращи основните механизми на IF, могат да представляват жизнеспособни възможности за лечение на DRM. Примерите включват трехалоза, дизахарид и спермидин, полиамин, за които е доказано, че повишават TFEB. IF обаче може да влоши сърдечните състояния, ако се прилага, когато автофагията и/или лизозомната функция е невъзстановима, като например при някои форми на лизозомни заболявания на съхранение. По този начин приложението на IF трябва да бъде внимателно оценено в зависимост от основните механизми на сърдечно-съдовите заболявания. В момента клиничното приложение на IF все още е на примитивен етап и очаква внимателна оценка на неговата безопасност и ефикасност, както и оптимизиране на протокола за хранене.
Източници на финансиране
Тази работа беше подкрепена отчасти от безвъзмездните средства на САЩ за обществено здравеопазване HL67724, HL91469, HL102738, HL112330, HL138720 и AG23039 (за Садошима). Тази работа беше подкрепена и от Трансатлантическата мрежа за върхови постижения на Фондация Ледук 15CBD04 (към Садошима) и Асоциация на основателите на Американската асоциация на сърдечните съдружници, постдокторска стипендия 18POST34060247 (към Мукай).
- Вестник с периодично гладуване - Donna Reish
- Как да направя 168 периодично гладуване; Постоянно губете мазнини
- Мейсън Хикс от Willis HS пада 145 килограма с периодично гладуване
- Загубих 20 KG с периодично гладуване и тренировка за сила от Hemanta Sapkota Medium
- Дженифър Анистън прави 16-те диета с гладко прекъсване - какво е това