Резюме
Комбинирането на кетогенна диета със стандартни химиотерапевтични и радиотерапевтични възможности може да помогне за подобряване на туморния отговор, въпреки че са необходими повече изследвания.
Още през 500 г. пр. Н. Е. Гладуването се използва като ефективно лечение на много медицински заболявания. Гладуването продължава и в съвремието, а през 1910 г. Гуелпа и Мари предлагат гладуването като антиепилепсийно лечение. През 1921 г. Woodyatt отбелязва, че гладът или употребата на диети с високо съдържание на мазнини и ниско съдържание на въглехидрати при лица без значителни съпътстващи заболявания водят до получаване на ацетон и β-хидроксибутират, 2 енергийни източника, произвеждани от черния дроб при липса на глюкоза. Смята се, че диетата с ниско съдържание на въглехидрати и мазнини е алтернатива на гладуването или гладуването, като има много от същите желани ефекти, като същевременно продължава да подхранва здравите клетки. По-късно терминът кетогенна диета (KD) е измислен от Уайлдър и Петерман, които формулират съотношението мазнини и въглехидрати, което се използва и до днес: 1 g протеин на kg телесно тегло при деца и 10 до 15 g въглехидрати дневно и мазнини за останалата част от калориите. И двамата изследователи съобщават, че тази диета подобрява ментацията и познанието на техните пациенти
Използването на KD като адювант при терапията на рака също започва да се появява. През 1922 г. Браунщайн отбелязва, че глюкозата изчезва от урината на пациенти с диабет, след като са диагностицирани с рак, което предполага, че глюкозата се набира в ракови области, където се консумира с по-високи от нормалните нива. По същото време Нобеловият лауреат Ото Варбург открива, че раковите клетки процъфтяват при гликолиза, произвеждайки високи нива на лактат, дори в присъствието на изобилие от кислород. Варбург проведе много опити in vitro и животни, демонстрирайки този резултат, известен като ефектът на Варбург.
До средата на 20-ти век употребата на KD в лечението на епилепсия и изследванията на рака е отслабнала. Въпреки това, в средата и края на 90-те години, със създаването на фондация Чарли, диетата бавно започна да възвръща признание. 1 Отчетени са резултати от много проучвания in vitro и животни и данните при хора също започват да се натрупват.
МЕХАНИЗМИ НА ДЕЙСТВИЕ
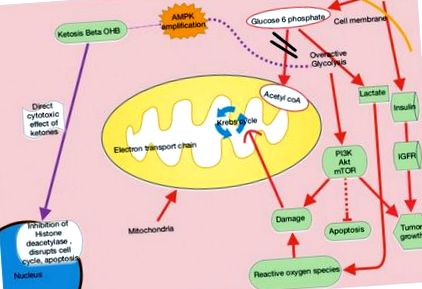
Глюкозата обикновено стимулира β клетките на панкреаса да отделят инсулин, което позволява на глюкозата да влезе в клетките и да осигури енергия. С висок прием на въглехидрати и глюкоза, панкреасът все повече отделя повече инсулин, който насърчава взаимодействието на рецепторите на растежния хормон и растежните хормони, за да произведе инсулиноподобен растежен фактор 1 (IGF-1) в черния дроб - насърчавайки клетъчния растеж и пролиферация, които могат да бъде вредно за пациенти с рак. Свръхекспресията на глюкозни транспортери 1 и 3 (Glut-1, Glut-3) също се среща при много видове рак и съответства на степента на усвояване на глюкоза при агресивни тумори, както се вижда при позитронно-емисионна томография (PET) .2 Свръхекспресия на хексокиназа, скоростта -ограничаващ ензима на гликолиза, допълнително стимулира производството на пируват и лактат, които причиняват увреждане на реактивните кислородни видове. Транслокацията на ензима, ограничаващ скоростта на хексокиназата, от цитозола във външната митохондриална мембрана, където той взаимодейства с зависими от напрежението анионни канали, може да наруши освобождаването на зависимия от каспаза цитохром, което потиска апоптотичните пътища на раковите клетки и прави рака по-устойчив на химиотерапия .3
Когато глюкозата е оскъдна, тялото усеща необходимостта да се направи алтернативна форма на енергия за клетките. След това черният дроб произвежда кетони и мастни киселини, които осигуряват нормални клетки, но не са от полза за раковите клетки. Раковите клетки имат дисфункционални митохондрии и евентуално дефекти на електронната транспортна верига, които нарушават нормалното производство на аденозин трифосфат (АТФ) от митохондриите. Резултатът е, че раковите клетки стават силно зависими от АТФ, идващи от по-малко ефективния процес на гликолиза (Фигура 1).
Кетогенни диетични метаболитни пътища
Кетогенните диети имитират състоянието на гладно, при което тялото реагира на липсата на глюкоза, като произвежда кетони за енергия. Излишното производство на лактат, което е част от ефекта на Варбург, компенсира производствените дефекти на АТФ, причинени от дисфункционално окислително фосфорилиране на митохондриите.2,4 Получената туморна зависимост от глюкозата може да бъде използвана при използване на KD. Кетогенните диети избирателно гладуват тумори, като осигуряват мазнини и протеини, които иначе не биха могли да бъдат използвани от глюкозозависими туморни клетки.
При KDs съотношението 4: 1 на високо съдържание на мазнини към ниско съдържание на въглехидрати имитира метаболитните ефекти на глада (Фигура 2). Тези диети забавят рака чрез инхибиране на инсулин/IGF и вътреклетъчни сигнални пътища надолу по веригата, като фосфоинозитид 3-киназа (PI3K)/протеин киназа В (Akt)/бозайници мишена на рапамицин (mTOR). Кетогенните диети също усилват аденозин монофосфат-активирана протеинкиназа (AMPK), която инхибира аеробната гликолиза и потиска туморната пролиферация, инвазия и миграция. Моделите на мишки с метастатичен рак показват, че самите екзогенни кетони имат директен цитотоксичен ефект върху жизнеспособността на тумора.5 β-хидроксибутиратът може да модифицира хроматина, като се свързва и по този начин инхибира хистоновата деацетилаза, като в крайна сметка потиска транскрипцията и ограничава пролиферацията на ракови клетки (Фигура 1).
Състав на макроелементите на кетогенните диети
КЕТОГЕННИ ПРЕДИМСТВА ЗА ДИЕТА
Има опасения относно предоставянето на протеини на пациенти, които са изложени на риск от бъбречни проблеми. Въпреки това, миши модели на диабетна нефропатия показват подобрена бъбречна функция при използване на KD. Хипотезата беше, че употребата на KD, която произвежда продължително повишени нива на 3-β-хидроксимаслена киселина, също намалява молекулярните реакции към глюкозата и следователно намалява бъбречното увреждане.6 Използването на диетата също намалява болката и възпалението както при млади, така и при възрастни плъхове. Смята се, че механизмите на действие намаляват реактивните кислородни видове и повишават централните нива на аденозин.7,8
НЕБЛАГОПРИЯТНИ ЕФЕКТИ
Диетата е загрижена за пациенти с рак, притеснени от допълнителна загуба на тегло. Стандартната диета се състои предимно от въглехидрати и има висока калорична стойност (Фигура 3). Бек и Тисдейл изследват ефекта от употребата на KD върху забавящата кахексия при миши модели на карцином на дебелото черво. Те откриха, че диетата е по-ефективна от инсулина при обръщане на загубата на тегло и има добавения ефект за намаляване на размера на тумора.7 Освен това, Тисдейл и колегите му установяват, че употребата на KD при пациенти с кахектичен рак може да насърчи наддаването на тегло.
Състав на макроелементите на модифицирани кетогенни (Аткинс) диети
Възможно обяснение е, че здравословното хранене на тъканите селективно забавя растежа на тумора, докато раковите клетки са лишени от хранене (въглехидрати). Терапевтичното плато с тегло трябва да следва първоначалната загуба на тегло с KD, за разлика от патологичната бърза загуба на тегло при пациенти без KD. 9 Камъни в бъбреците, подагра и симптоматична хипогликемия също са потенциални очаквани неблагоприятни ефекти (AE).
Доклади за случаи
ТЕКУЩО ИЗСЛЕДВАНЕ
В сравнение с нормалните мишки, носещите тумор мишки, поставени на диета с ниско съдържание на въглехидрати, са имали по-ниски нива на глюкоза, инсулин и млечна киселина.4 Проучване in vivo за микродиализа на пациенти с рак на главата и шията установи намалени нива на млечна киселина в туморните тъкани след 4-дневна KD.13 Повечето ранни проучвания и доклади за случаи, включващи KD при рак, са фокусирани върху мозъчни тумори.11,14-16 Клиничните проучвания върху тази диета при грижа за рак са ограничени до малки, нерандомизирани, кратки проучвания (4-12 седмици ) или отделни казуси (Таблица) .11,17–20
Таблица
Пилотни изпитания за безопасност и поносимост с ниско съдържание на въглехидрати
| ПРЕЗАРЕЖДАНЕ: Фино и колеги17 | 4 седмици | 10 Гърди Яйчникови/фалопиеви Колоректален Бял дроб Езофагеална | 5 | 5 | 0 | 5 (4 седмици) | 4 | 1 | Средна загуба на тегло: 4,1% (P = .45) Няма неблагоприятни ефекти | Модифицирана диета на Аткинс: 20 въглехидрати g/d Неограничен протеин 2 чаши зеленчуци на ден Кетозата корелира със стандартизираната стойност на поглъщане при позитронно-емисионна томография - компютърна томография Стабилно заболяване, корелирано с 3-кратна кетоза (P = .018) |
| ERGO: Ригер и колеги | До прогресия | 20. Рецидивирал глиобластом | 17 | 3 Лош прием | 0 | 0 | 17 1 незначителен отговор 2 пациенти със стабилно заболяване (6 седмици) | Виждано само след спасителна химиотерапия със или без облъчване общо 8 пациенти са получили спасяване 1 пълен отговор 5 частични отговора | Средна загуба на тегло: 2,2% (статистически значима) 2 пациенти са имали левкопения степен 3 Няма друг клас 3 неблагоприятни ефекти | 60 въглехидрати g/d Нисковъглехидратна диета и растителни масла Неограничени калории Основна крайна точка:% прекратяване на диетата Вторични крайни точки: безопасност,% постигане на кетоза, качество на живот 8 от 17 пациенти с прогресиращо заболяване са подложени на спасителна химиотерапия и диетични промени, което е довело до 5 частични отговора и 1 пълен отговор Средна обща преживяемост с диета: 32 седмици Средна преживяемост без прогресия: 5 седмици |
| Изследване на Вюрцбург: Шмид и колеги19 | 5–12 седмици | 16. Маточно-яйчникова Гърди Паротидна Саркома Панкреас Щитовидна жлеза Дебело черво Бял дроб | 5 (12 седмици) 2 (6 седмици) 2 (7 седмици) 2 (8 седмици) 1 (5 седмици) 1 (4 седмици) 3 (2 седмици) | 3 | 2 | 5 | 6 | 0 | Средна загуба на тегло: 2,9% (P> NCT00932672) от диетата на Аткинс и терапия за лишаване от андроген за пациенти с рак на простатата. Медицинският център в Тел Авив Сураски в Израел набира предварително лекувани пациенти с химиотерапия с висококачествени глиални тумори за открито проучване (> NCT01092247) за ефикасността на KD за предотвратяване на растежа и рецидивите на тумора. Болница и медицински център „Сейнт Джоузеф“ (Финикс, Аризона) набира новодиагностицирани пациенти с глиобластом за проспективно проучване фаза 1/2 (> NCT02046187), включващо предварителна резекция, последвана от KD с лъчетерапия и едновременна темозоломидна химиотерапия. Първичната крайна точка е броят на пациентите с AE, а вторичните крайни точки са общата преживяемост, времето до прогресия и QOL. Университетът в Айова набира пациенти с рак на простатата и недребноклетъчен рак на белия дроб за 2 проучвания фаза 1 (> NCT01419483 и> NCT01419587, съответно), включващи KD, използвайки Nutritia KetoCal 4: 1 (Gaithersburg, MD). |
ЗАКЛЮЧЕНИЕ
Данните от доклади за случаи и проучвания показват, че употребата на KD е безопасна и поносима за пациенти с рак. Въпреки че би било идеално да се проведе по-голямо проучване, като се използва рандомизиран терапевтичен подход, настоящият акцент върху опитите, базирани на лекарства, е огромна пречка. Други основни пречки са инициативата и придържането на пациента. Засега разследващите трябва да работят с анекдотични данни. Изследването на моделите на генна експресия в митохондриите и мутациите в кетолитичните и гликолитичните ензими може да се окаже полезно при подбора на потенциално реагиращи пациенти. Комбинирането на този диетичен подход със стандартни химиотерапевтични и радиотерапевтични възможности може да помогне за подобряване на туморната реакция и отчаяно са необходими допълнителни изследвания.
Макронутриентен състав на стандартните диети
Бележки под линия
Разкриване на автор
Авторът не съобщава за действителни или потенциални конфликти на интереси по отношение на тази статия.
- Кетогенни диети като адювантна терапия на рака История и потенциален механизъм
- Нарастващите доказателства подкрепят много ползи от диетите на месна основа Beef Magazine
- Високопротеинови диети и риск от рак
- Високопротеинови диети за отслабване и предполагаеми неблагоприятни ефекти Къде са доказателствата
- Високопротеинови диети, свързани с рака, ако се притеснявате