Резюме
Затлъстяването е причинен фактор за диабет тип 2 (T2D); Въпреки това, хората без затлъстяване (включително слаби, нормално тегло или наднормено тегло) все още могат да развият T2D. T2D без наднормено тегло е разпространен в Азия и често се среща в Европа. Напоследък множество доказателства се противопоставят на идеята, че или затлъстяването, или централното затлъстяване (висцерално натрупване на мазнини) насърчава T2D без затлъстяване. Няколко фактора като възпаление и фактори на околната среда допринасят за затлъстяването на T2D. Според данните, получени от мишки с нокаут на гени и клинични проби за T2D в Азия и Европа, патогенезата на T2D без затлъстяване е разкрита наскоро. Намаляването на регулацията на MAP4K4 в Т клетки води до подобряване на IL-6 + Th17 клетъчната популация, което води до инсулинова резистентност и T2D както при хора, така и при мишки. Освен това, полиморфизмите с единичен нуклеотид MAP4K4 и епигенетичните промени са свързани с пациенти с T2D. Взаимодействията между вариантите на гена MAP4K4 и факторите на околната среда могат да допринесат за затихване на MAP4K4 в Т-клетките, което води до не-затлъстяване T2D. Бъдещите изследвания на патогенезата на затлъстяване T2D ще доведат до разработването на прецизни лекарства за затлъстяване T2D.
Заден план
Основен текст
Липса на разбиране за затлъстяване T2D
Популацията на затлъстяване или постно T2D може да бъде подценена по целия свят. Пациентите със затлъстяване, страдащи от затлъстяване, показват значително по-висока оценка на „неприемането на диабет“, отколкото пациентите със затлъстяване; много слаби хора не подозират, че могат да имат T2D [4]. Забележително е, че пациентите с Т2D без наднормено тегло имат повишен риск от сърдечни заболявания и по-бърза прогресия към лечение с инсулин в сравнение с пациенти със затлъстяване T2D [1, 5, 6]. Освен това „тийнейджърите с наднормено тегло стават жертва на T2D“, Азиатска епоха докладвано през 2015 г. Не бива да пренебрегваме, че много хора със затлъстяване или слаби хора страдат от T2D.
Към днешна дата най-голямо внимание и ресурси са насочени към изследване на T2D, предизвикано от затлъстяване. Въпреки това, патогенезата на T2D без затлъстяване не може лесно да бъде разкрита, като се използват проби от хора от Северна Америка поради малките размери на пациентите с T2D без затлъстяване. Също така не може да бъде демонстрирано от модела на животни, хранени с високо съдържание на мазнини (HFD), който не е подходящ за изследване на T2D без затлъстяване. В някои случаи проучвания от западни страни съобщават за потенциални рискови фактори (като единични нуклеотидни полиморфизми (SNP) на инсулиновия рецепторен субстрат 1 (IRS-1)) за T2D [7]; обаче връзката между тези рискови фактори и T2D не може да бъде възпроизведена, като се използват предимно пациенти със затлъстяване с T2D от азиатски страни като Турция [8], Япония, Индия и Тайван [7]. По този начин става ясно, че механизмът на заболяването при затлъстяване T2D е различен от този при затлъстяване T2D [9, 10]. Освен това, причинно-следствените връзки на рисковите фактори при не-затлъстели T2D не могат да бъдат демонстрирани поради липсата на подходящи животни с не-затлъстяване T2D. Тези ограничения водят до бавен напредък в разбирането ни за патогенезата на T2D без затлъстяване.
Противоречието относно натрупването на висцерална мастна тъкан при затлъстяване с наднормено тегло
Смята се, че централното затлъстяване, определено от повишеното натрупване на висцерални мазнини, е риск от T2D както при европейците, така и при азиатците [11]. Данните, получени от 290 японски американци от второ поколение със средна възраст 61,8 години, показват, че интраабдоминалните мазнини са само леко корелирани с честотата на T2D (коефициент на шанс = 1,5), докато глюкозата на гладно, нарушен глюкозен толеранс (IGT) в началото, женски пол или фамилна анамнеза за диабет корелира с честотата на T2D (коефициент на шансове = съответно 2,3, 3,8, 3,1 и 1,9) при същия мултивариатен модел [12]. В Индия както натрупването на централна коремна мастна тъкан, така и висцералната мастна тъкан са съвсем леко свързани с T2D (коефициентът на шансове = съответно 1.001 и 1.011) [13].
MAP4K4 генни полиморфизми и не затлъстяване T2D
Наскоро няколко групи идентифицираха MAP4K4 (наричан също HGK; да не се бърка с човешката глюкокиназа и човешкия жлезист каликреин, които са наречени hGK) като рисков фактор за постно T2D. MAP4K4 е член на киназите от семейство MAP4K [20, 21]; MAP4K1 [22] и MAP4K3 [23] са докладвани като важни регулатори на активирането на Т-клетките [24, 25]. MAP4K4 е необходим за миграция на ракови клетки и е свързан с метастази на рак [26–29]. MAP4K4 също играе важна роля за подвижността на ендотелните клетки [30].
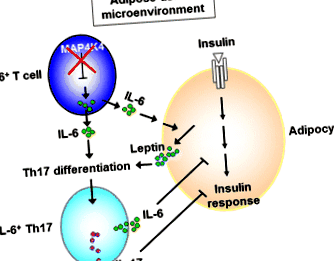
Рисковият фактор за T2D в Европа е изследван с помощта на ДНК на периферна кръв от кохортата на семейство Tübingen (TÜF) (н = 1,769) и извлечената от Потсдам потенциална случайна кохорта от EPIC (н = 2971) [31]. Те откриха, че SNP на КАРТА4K4 локус (rs11674694) се свързва с повишени нива на глюкозен толеранс към орален глюкозен тест (OGTT), намалена инсулинова чувствителност и повишени рискове от T2D [31]. В по-малка подгрупа това КАРТА4K4 SNP (rs11674694) и две други КАРТА4K4 SNPs (rs13003883 и rs2236936) също са свързани с повишени плазмени нива на IL-6, но не и на TNF-α [31]. Освен това КАРТА4K4 SNPs (rs2236936 и rs2236935) са свързани с намалено освобождаване на инсулин само при слаби субекти (BMI + Th17 клетки чрез синергичен ефект на лептин и IL-6 в мастната тъкан (фиг. 1) [34]. Тези патогенни IL-6 + Th17 След това клетките циркулират в други насочени към инсулина тъкани (черния дроб и мускулите), което води до инсулинова резистентност.
Диференциация на патогенна IL-6 + Th17 клетка в мастната тъкан. Дефицитът на MAP4K4 в Т клетките води до свръхпродукция на IL-6. Тези Т-клетки, продуциращи IL-6, се инфилтрират в мастната тъкан. В микросредата на мастната тъкан IL-6, секретиран от Т-клетки, продуциращи IL-6, усилва секрецията на лептин от адипоцитите. Лептинът си сътрудничи с IL-6 за насърчаване на диференциацията на Th17, което води до развитие на патогенни клетки IL-6 + Th17 [34]
Клиничното значение на MAP4K4 регулирани надолу IL-6 + Th17 клетки се потвърждава, като се използват пречистени Т клетки от пациенти с T2D. Последователно, нивата на MAP4K4 са намалени в Т-клетките на периферната кръв от 72% пациенти с T2D, които не са лекувани с лекарства в Тайван [35]. В това проучване всички слаби пациенти с T2D показват както понижаване на регулирането на MAP4K4, така и свръхпродукция на IL-6 в Т-клетки [35]. Честотите на Т-клетките, продуциращи IL-6, са свързани със стойността на индекса на инсулинова резистентност [35]. Честотите на Т-клетките, продуциращи IL-6, могат да бъдат намалени чрез ектопично експресиран MAP4K4 [35]. Тези открития предполагат, че понижаването на MAP4K4 в Т-клетките допринася за T2D. Независимо от това, поради малкия обем на извадката, авторите не са демонстрирали, че процентът на затлъстелите лица с MAP4K4 затихване е по-нисък от този на не-затлъстелите субекти в тяхното проучване [35]. Освен това, данните за лечение с деметилиране на пречистени Т-клетки от пациенти с T2D показват, че понижаването на регулирането на MAP4K4 се дължи на засилено метилиране на промотора на MAP4K4 [35]. Освен това честотите на метилиране са свързани с нивата на глюкоза OGTT, независимо от затлъстяването; тази корелация е особено по-висока при подгрупата на пациента с BMI + Th17 клетки и не затлъстяване T2D
Диетата с високо съдържание на мазнини (HFD) предизвиква популация на IFN-γ + Т клетки при мишки [36, 37]. Освен IFN-y + Т клетки, възпалителните макрофаги и В клетките също допринасят за HFD-индуциран T2D [37, 38]. Липсата на MAP4K4 в Т клетки води до индукция на IL-6 + Th17 клетка, но не и макрофаги или В клетки, популация в MAP4K4 cKO мишки [34]. За разлика от IFN-y + Т клетките, популацията на IL17 + Т клетки при мишки не може да бъде индуцирана от HFD [36]. По-специално, MAP4K4-дефицитните IL-6 + Th17 клетки са патогенни клетки, причиняващи спонтанен T2D при специфични за Т-клетките MAP4K4 мишки с условно нокаутиране (cKO), както и при здрави реципиентни мишки след осиновяване на трансфер [34].
Профилактика и терапевтични стратегии за не-затлъстяване T2D
Нарушеният глюкозен толеранс (IGT) е състояние преди диабет. Честотите на IL-6-продуциращите Т-клетки от пациенти с IGT са между тези на T2D и здрави индивиди [35]. Това откритие предполага, че изследването на IL-6 + IL-17 + Т-клетъчната популация или MAP4K4 метилиране може да осигури ранна диагноза или дори прогноза за затлъстяване или постно T2D.
Нивата на метилиране на ДНК могат да се регулират от фактори на околната среда като диети, патогени, токсини, радиация, хормони на околната среда, замърсяване на въздуха и стойност на pH на водата. Добре известно е, че замърсяването на въздуха (като частици, PM2.5) е свързано с разпространението на T2D. Интересното е, че излагането на озонови окислени частици черен въглерод предизвиква възпалителни Т-клетъчни популации в медиастиналните лимфни възли, както и нива на IL-6 в бронхоалвеоларни течности за промиване на мишки от див тип [40]. Освен това, специфичните за Т-клетките нокаутиращи мишки MAP4K4 показват по-тежко белодробно възпаление от това при мишки от див тип при излагане на озонов окислен черен въглерод [40].
Предлагаме взаимодействието между факторите на околната среда и КАРТА4K4 полиморфизмите/метилирането допринасят за понижаване на регулацията или инактивация на MAP4K4 в Т-клетките, което води до T2D без затлъстяване. По този начин, изследването на връзката между факторите на околната среда и експресията/дисфункцията на MAP4K4 може да помогне за предотвратяване на затлъстяване T2D. В допълнение, функционалното значение на SNP на КАРТА4K4 трябва да бъде разследван. Също така ще бъде полезно да се изясни дали КАРТА4K4 SNP и хиперметилирането на MAP4K4 съществуват едновременно или се срещат независимо при пациенти със затлъстяване с T2D от различни страни или различни етнически групи. Освен MAP4K4, други гени (като сигнални молекули) и фактори на околната среда, които индуцират патогенна IL-6 + Th17 клетъчна популация, също могат да бъдат включени в патогенезата на не-затлъстелите T2D. Също така е важно да се проучи дали други неизвестни патогенни популации от имунни клетки също допринасят за не затлъстяване T2D.
Инхибирането на възпалителните Т-клетки може да бъде полезен подход за лечение на затлъстяване или постно T2D. Или неутрализацията на IL-6 или IL-17 подобрява инсулиновата чувствителност при мишки с диабет MAP4K4 cKO [34]. Няколко проучвания от Япония [41] и Европа [42] показват, че пациентите с ревматоиден артрит, получаващи лечение с анти-IL-6 рецептор (тоцилизумаб), също показват намалени нива на HbA1c и подобрена инсулинова чувствителност. По този начин, IL-6 или IL-17 блокадата може да се разглежда като лечение на не-затлъстяване T2D. В допълнение, ектопичното лечение с MAP4K4 експресия или деметилиране инхибира производството на IL-6 в пречистени периферни Т клетки на пациенти с T2D [35]. Тъй като MAP4K4 е повсеместно експресиран и свръхекспресията на MAP4K4 насърчава прогресията или метастазите на рака [21, 26], системно лечение, използващо агонисти на MAP4K4, може да не е осъществимо. По този начин, идентифицирането на специфичен за Т-клетките епигенетичен регулатор на метилиране на промотор на MAP4K4 може да помогне за разработването на потенциално лечение на не-затлъстели T2D чрез селективно възстановяване на MAP4K4 в Т-клетки.
Взаимодействие на T2D с ревматоиден артрит
Ревматоидният артрит (RA), псориатичният артрит или псориазисът е свързан с повишен риск от T2D [43, 44]; обратно, T2D се свързва със значително повишен риск за RA [45]. Възпалителните цитокини IL-6 и IL-17 играят важна роля в патогенезата на RA, псориатичен артрит или псориазис. В допълнение, IL-6 + Th17 клетките са критични патогенни клетки за не-затлъстели T2D [34, 35]. Тези открития предполагат, че възпалителните Th17 клетки могат да бъдат често срещани патогенни клетки за T2D, RA, псориатичен артрит и псориазис. По този начин, наблюдението на пациенти с RA или T2D за възпалителни Т-клетки ще помогне за ранната диагностика на другото заболяване.
Заключения
Различни патогенни пътища за не затлъстяване T2D и затлъстяване T2D. За затлъстяване T2D, взаимодействието между факторите на околната среда и гените на гена MAP4K4 може да засили метилирането на промотора MAP4K4, което води до понижаване на регулирането на MAP4K4. Впоследствие регулирането на MAP4K4 в Т-клетките води до свръхпродукция на проинфламаторните цитокини IL-6 и IL-17, което води до инсулинова резистентност на клетките, насочени към инсулина. При затлъстелите T2D диетата с високо съдържание на мазнини е причина за затлъстяване и натрупване на висцерална мазнина, което води до свръхпродукция на провъзпалителния цитокин IFN-γ от Т клетки [36, 37], IgG автоантителата от В клетките [38] и противовъзпалителното цитокини TNF-α, IL-1β, IL-6 от макрофаги [46]. Освен макрофагите, IL-6 се произвежда и от адипоцити, хепатоцити, мускулни клетки и В клетки на мишки, хранени с високо съдържание на мазнини [47]. В-клетките, индуцирани с високо съдържание на мазнини, набират макрофаги в насочени към инсулин тъкани и активират Т-клетките за производство на IFN-γ [38]. TNF-α и IFN-y причиняват инсулинова резистентност [46]. Както при затлъстяване T2D, така и при затлъстяване T2D, инсулиновата резистентност допълнително индуцира чернодробна и сърдечна стеатоза
- Лираглутид за диабет тип 2 и затлъстяване актуализация от 2015 г. - PubMed
- Как да се храним здравословно и да се чувстваме чудесно с диабет тип 1
- Списък на лекарствата за диабет, тип 2 (161 в сравнение)
- Лираглутид подобрява паметта при пациенти със затлъстяване с преддиабет или ранен диабет тип 2 a
- Живот с диабет тип 2 за ежедневието