Резюме
Хранителните вещества и биоактивните молекули, получени от храната, трябва да преминават през сложни метаболитни пътища и тези пътища варират при хората. Метаболитната хетерогенност се причинява от генетични вариации, епигенетични вариации, разлики в състава и функцията на микробиома, различия в начина на живот и от вариации в експозицията на околната среда. Този преглед обсъжда редица от тези източници на метаболитна хетерогенност и представя някои от изследователските инвестиции, които ще са необходими, за да се направят приложенията на прецизното хранене практически.
Въведение
За да се развие това разбиране, има належаща нужда от разработване на усъвършенствани методи за оценка на много от тези фактори, които допринасят за метаболитната хетерогенност, за по-добри изчислителни и информативни инструменти, които могат да се използват за моделиране на сложните взаимодействия между източниците на метаболитна хетерогенност при хората, и за по-добри инструменти за превръщане на науката и моделите в тестове и интервенции, които здравните специалисти могат да прилагат. Способността да се постигнат тези цели за прецизно хранене ще отнеме значителни инвестиции на интелект, пари и време (Таблица 1).
маса 1
Инвестиции, необходими за подобряване на прецизното хранене.
| Оценка на диетата |
| 1. Разработване на по-добри биомаркери за оценка на приема на диета 2. Разработване на по-добри инструменти за измерване на приема на диета |
| Генетична вариация |
| 1. Разработване на по-голям каталог на функционални генетични варианти 2. Още проучвания, които събират генетични данни, прием на диета и здравни резултати 3. Разработване на метаболомични и информативни инструменти за валидиране на генетични варианти, които нарушават метаболизма при хората 4. По-добри информативни подходи за интегриране на данни в различни модели на генетични варианти |
| Епигенетична вариация |
| 1. Разработване на методи за оценка на епигенетични модификации в тъкани, които не са лесно достъпни за хората 2. Подобрено разбиране на критичните събития и време, които водят до епигенетични промени, които променят човешкия метаболизъм. 3. Разработване на по-голям каталог на функционални епигенетични промени (които променят човешкия метаболизъм) |
| Вариация на микробиома |
| 1. Разработване на по-добри методи за идентифициране на функцията на микробиотата по отношение на ефектите върху човешкия метаболизъм 2. Включване на по-добра оценка на приема на диета в дизайна на проучвания за микробиота 3. Разработване на по-добро разбиране на ефектите от диетата и експозицията върху популациите и функциите на микробиотите |
| Промяна на експозицията |
| 1. Разработване на по-добри методи за идентифициране на експозома при хората (молекулите на околната среда, на които хората са изложени) 2. Идентифициране на функционални компоненти на експозома (които променят човешкия метаболизъм) |
| Вариация на начина на живот |
| 1. Разработване на по-добри биомаркери за оценка на начина на живот (особено физическата активност) 2. Разработване на по-добри инструменти за измерване на начина на живот (особено физическата активност) 3. Разработване на по-голям каталог с функционални варианти на начин на живот (особено физическа активност) по отношение на ефектите върху човешкия метаболизъм. |
| Системна биология |
| 1. Развитие на по-добро разбиране на взаимодействията между всички горепосочени източници на метаболитни вариации 2. Разработване на по-добри информационни инструменти за интегриране на данни от всичко по-горе по отношение на варианти, които нарушават човешкия метаболизъм |
| Превод на практика |
| 1. Разработване на по-добри програми за обучение на здравни специалисти и общественост по прецизно хранене 2. Разработване на прецизни хранително-ориентирани интервенции за хора с метаболитни смущения, които причиняват здравословни проблеми. 3. Разработване на информатика, която може да използва дефинираните по-горе данни за идентифициране на подходящи хранителни и диетични интервенции при хора с метаболитни нарушения, които причиняват здравословни проблеми |
Източници на тази метаболитна хетерогенност, свързана с храненето
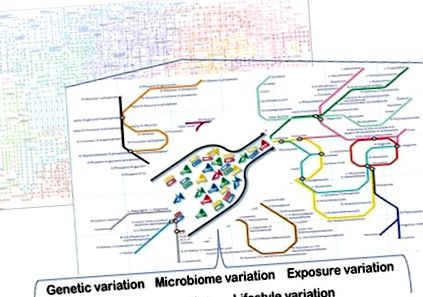
Съществуват широк набор от фактори, които допринасят за метаболитната хетерогенност при хората. Генетични вариации, епигенетични вариации, свързани с микробиоми вариации, вариации в начина на живот (напр. Физическа активност, разлики в поведението при хранене) и вариации в химичните и други експозиции, присъстващи в околната среда на човек, са само няколко от тези фактори (Фигура 1). Някои от тези фактори се разбират по-добре от други и този преглед се фокусира върху тях.
Източници на метаболитна хетерогенност. Precision Nutrition се основава на разбирането на основните източници на метаболитни вариации. Те включват генетични, епигенетични, микробиоми, различия в начина на живот и въздействието върху хората. Някои от тези вариации създават неефективност (тесни места) в метаболизма, които са свързани с неблагоприятни здравни резултати при хора, които са предизвикани от диетата си. Изчислителното и математическо моделиране на основните сложни биологични системи, които са включени, и използването на тези модели за разработване на индивидуализирани интервенции са основите за практиката на прецизно хранене.
Генетични вариации като източник на свързана с храненето метаболитна хетерогенност
Метаболизмът включва функцията на много метаболитни пътища, като всяка стъпка в тези пътища се медиира от протеини, кодирани от гени. Кодоните в екзоните на гените определят аминокиселинната последователност на протеиновите продукти. В допълнение, генетичният код в промоторните региони (обикновено в близост до тези екзони) съдържа последователности от отговори, които могат да се свържат с външни сигнали, които определят дали генът е включен или изключен от регулаторни подобрители като хормони, антиоксиданти, калций, метали и др. . (Resseguie et al., 2011; Hou et al., 2012). И накрая, някои региони на ДНК не кодират за протеинови продукти, а по-скоро за некодиращи РНК, които регулират дали гените се транскрибират или получената иРНК се трансформира в протеин (Mirra et al., 2018).
Хората имат милиони вариации в „изписването“ на своя генетичен код (всеки отделен човек има около 50 000 от тези единични нуклеотидни полиморфизми (SNP)) (Overbeek et al., 2005; Sabeti et al., 2007). Тези генетични вариации се наследяват от древните предци и следователно се различават сред хората в зависимост от тяхното наследство (Overbeek et al., 2005; Sabeti et al., 2007). Някои от тези SNPs водят до замествания на кодони в критични гени на метаболизма, които променят тяхната експресия, функция или По този начин, вариациите в генетичния код на човек могат да повлияят на това колко от критичния метаболитен ензим (или транспортер, или рецептор) е на разположение (чрез промяна на скоростта на синтеза на протеина или чрез промяна на аминокиселинните остатъци, които засягат полу- живот на протеина) и/или генетични вариации могат да променят доколко добре работи протеинът (чрез промяна на аминокиселинните остатъци, които влияят върху начина, по който ензимът се свързва със своя субстрат или които влияят върху това как протеинът катализира реакциите, включващи този субст ставка). Такива функционални SNP са един източник на метаболитна хетерогенност и могат да причинят разлики между хората в това как те реагират на хранителна или биоактивна молекула.
Тъй като генетичният код на човек остава относително постоянен през целия живот, силата на такива прогнози, базирани на генни варианти, е, че те са измерими по всяко време от живота, за разлика от повечето други рискови фактори. Налични са отлични молекулярни инструменти за оценка на генната последователност и генетичните полиморфизми. Поради тази причина нутригенетиката/нутригеномиката напредва по-бързо, като допринася за прецизното хранене. Генетичните вариации обаче допринасят само за метаболитната хетерогенност.
Епигенетични разлики като източник на метаболитна хетерогенност
Самият генетичен код не е достатъчен, за да се предскаже фенотип. Клетките в тялото имат много различни функции в различни тъкани и органи, въпреки че съдържат почти идентичен генетичен код. Тези разлики се дължат на епигенетичната регулация на генома (Ideraabdullah and Zeisel, 2018). Епигенетичната регулация включва поставяне на химически белези върху ДНК или хистони от ензими, известни като автори, тези белези трябва да бъдат разпознати от специфични регулаторни ензими, наречени четци, които след това потискат или активират генната транскрипция или потискат транслацията на иРНК в протеин и в крайна сметка ефектите от тези марки трябва да бъде завършен от ензими, наречени гумички, които премахват епигенетичните белези. Към днешна дата има два вида епигенетични белези при хората: ковалентни модификации на ДНК и ковалентни модификации на хистонови протеини.
ДНК метилирането е най-широко изследваната епигенетична марка. ДНК се метилира чрез добавяне на метилова група към цитозин, за да се получи 5-метилцитозин (5mC). При хората 5mC се среща предимно при палиндромни CG динуклеотиди (Szyf, 2005). Наличието на 5mC в локуса е свързано или с генна репресия, или с активиране в зависимост от местоположението в гена (Jones, 2012). Например, докато 5mC в промоторните области често е свързано с генна репресия, 5mC в генното тяло (интрони и екзони) често е свързано с генна активация (Ideraabdullah and Zeisel, 2018). 5mC често не инициира заглушаване на гена, а по-скоро действа като механизъм за поддържане на заглушеното състояние на ген (Jones, 2012). ДНК метилирането предизвиква метаболитна хетерогенност, но обратно диетата и метаболитната хетерогенност влияят върху метилирането на ДНК (Jones, 2012). Метиловите групи, използвани за маркиране на ДНК, са получени от S-аденозилметионин, който е получен от диетичния метионин, 5-метилтетрахидрофолат и бетаин (от холин), а метилирането на ДНК е директно модулирано чрез хранителен прием (Wolff et al., 1998; Szyf, 2005; Dolinoy et al., 2006; Waterland et al., 2006, 2007; Mehedint et al., 2010; Jones, 2012; Dominguez-Salas et al., 2014; Ideraabdullah and Zeisel, 2018). Наскоро бяха прегледани методи за оценка на метилирането на ДНК (Shen and Waterland, 2007).
За разлика от ДНК последователността, епигенетичните белези и некодиращите РНК са променливи по време на живота, особено по време на ранния живот, и тези промени медиират пренастройката на метаболизма, за да се приспособят към реалността на хранителните вещества и околната среда (Ideraabdullah and Zeisel, 2018). По този начин времето за събиране на данни е важно. Това добавя слой сложност, с който ще трябва да се работи, тъй като науката за прецизното хранене се усъвършенства. Метаболизмът на хранителните вещества не само се модифицира от епигенетичните различия, но самите тези различия се влияят от приема на храна и околната среда (Ideraabdullah and Zeisel, 2018).
Микробиомът като източник на метаболитна хетерогенност
Стомашно-чревният тракт е основният път, по който хората имат достъп до хранителни вещества; колонизиран е от трилиони микроби (Qin et al., 2010). Тези микроби са се развили с течение на времето, за да процъфтяват в човешкия стомашно-чревен тракт, заедно, техните геноми са десет пъти по-големи от човешкия геном и те могат да метаболизират почти всеки субстрат, който им се представя (Goodman and Gordon, 2010). Често тези микроби получават достъп до тези хранителни вещества, преди те да станат достъпни за хората, които колонизират, а микробите метаболизират храните и правят малки молекули, които хората след това усвояват (Manor et al., 2014; Hall и Versalovic, 2018) Това може да модулира колко енергия хората получават от храни (Scheithauer et al., 2016), да осигуряват на хората основни витамини [като витамин К (Ramakrishna, 2013)], да създават регулаторни молекули като късоверижни мастни киселини (Ramakrishna, 2013), и модифицират наличността на други основни хранителни вещества [като холин (Zeisel and Warrier, 2017)]. Хората се различават значително в микробите, които приютяват (Eckburg et al., 2005), поради което микробите, населяващи червата ни, са важен източник на метаболитна хетерогенност между хората.
- Всичко за хранителните оцветители Прецизно хранене
- Всичко за ендокринните разрушители Прецизно хранене
- Рецепта за черен боб; Nutrition Precision Nutrition; s Енциклопедия на храните
- Рецепта за скуош от Butternut; Nutrition Precision Nutrition; s Енциклопедия на храните
- Повишаване на възстановяването Решения за най-често срещаните проблеми с възстановяването Precision Nutrition