Резюме
Въведение
Повече от 5,3 милиона лица страдат от увреждане, свързано с травматично мозъчно увреждане (TBI), само в САЩ (1). Най-високото съобщено увреждане след TBI е развитието или влошаването на психиатрични разстройства, включително депресия, тревожност и разстройства на настроението, което може да доведе до общо понижено качество на живот и повишена дългосрочна смъртност (2, 3). Например, едно проучване съобщава, че почти половината от пациентите, страдащи от психиатрично разстройство, започват да изпитват симптоми едва след TBI (4, 5). Основен принос за развитието или влошаването на психиатрични разстройства след TBI е неадаптивното възпаление и микроглиалното грундиране (6, 7). Все повече доказателства показват, че променената реакция на стреса може значително да компрометира посттравматичното възстановяване и да изостри и без това възпаленото състояние на мозъка, което може да продължи дългосрочните вредни резултати след TBI.
Най-общо, стресът е как тялото реагира на промените в околната среда, за да поддържа активно хомеостазата (8). Алостазата е процес, чрез който хомеостазата се поддържа чрез промяна. Алостазата се постига чрез координирано активиране и регулиране на оста хипоталамус-хипофиза-надбъбречна жлеза (HPA), която освобождава стресовите хормони при активиране. Основният хормон на стреса е кортизол при хора и кортикостерон при гризачи, и двете ще бъдат наричани CORT в този преглед. CORT действа за регулиране на реакциите на стрес в организма и за контрол на други процеси, които поддържат хомеостатичния баланс, особено възпалението и съня. Дисрегулирането на отговора на CORT на стресови, както и нестресиращи стимули може да има далечни последици върху цялостното здраве и възстановяване от травматично увреждане.
Клиничните данни показват, че надбъбречната недостатъчност поради потиснато активиране на оста HPA след TBI се среща в една четвърт от всички случаи на TBI (9). Тези клинични проучвания показват, че TBI предизвиква базови промени в невроендокринната функция, но не дават представа дали тези промени влияят върху реакцията след нараняване и възстановяването от стресови стимули, т.е. алостаза. Дисфункцията на оста след TBI HPA води до неподходящи реакции на стрес, което от своя страна може да наруши регулирането на възпалението. И двата процеса са замесени в развитието на психиатрични разстройства след TBI; обаче кръстосаните разговори между стресово-имунните пътища след мозъчно увреждане остават недостатъчно проучени както в предклиничните, така и в клиничните проучвания.
Този преглед ще отчете преглед на невровъзпалението след TBI, както и дискусия относно взаимовръзката между стресово-имунните пътища след мозъчно увреждане. След това ще обсъдим клиничната честота на дисфункция на оста след TBI HPA и как експерименталните модели на TBI са докладвали по подобен начин променена реакция на стрес. И накрая, ще обсъдим експериментални подходи за характеризиране на дисфункция на оста след TBI HPA. Акцент ще бъде поставен върху стойността на комбинираните модели стрес-TBI, които изясняват молекулярните механизми, свързващи невроендокринното увреждане с имунната дисрегулация.
Невровъзпаление след TBI
TBI възниква в две фази: първично и вторично увреждане. Първичното нараняване се причинява от механични сили на самото нараняване и включва аксонално срязване, кръвоизлив и контузия (10). Първичното нараняване възниква в различна степен на тежест, често наричано леко, средно или тежко. Има много видове TBI, които могат свободно да бъдат категоризирани в дифузен и фокусен TBI. Примери за дифузен TBI са взривни наранявания или хипоксично-исхемични наранявания, които имат широко разпространено увреждане, но не образуват отделна лезия, докато фокалната TBI включва черепни фрактури или чужди тела като куршум или шрапнел, които водят до лезия. Има много различни експериментални модели на животни с TBI, които представят както дифузен, така и фокусен TBI (11). Често срещан модел на дифузен TBI е перкусионното нараняване с течност (FPI), което се постига чрез прилагане на течен импулс към непокътната твърда мозъчна обвивка (12). Контролираното кортикално въздействие (CCI) представлява фокусен модел на TBI, причинен от бутало, приложено директно върху мозъка, което води до контузия (13). Използването на тези различни видове модели на нараняване е жизненоважно за изследванията на TBI за разработване на предпазни мерки и намаляване на въздействието на различни форми на първично нараняване.
Вторичното увреждане се причинява косвено от TBI и е резултат от продължителни процеси, инициирани от травма, включително оток или промени в кръвния поток. Освен това вторичното увреждане представлява невронално увреждане и дегенерация чрез молекулярни процеси, включително митохондриална дисфункция (14), оксидативно увреждане (15) и невроинфламация (16), което го прави потенциална цел за фармакологична интервенция след TBI. Невроинфламацията представлява особен интерес при вторично увреждане, тъй като е замесена в развитието на невродегенеративно заболяване след нараняване (17, 18). Както беше прегледано по-рано, много видове клетки допринасят за невровъзпалителния отговор след TBI (19, 20), но голяма част от предклиничните и клиничните изследвания са фокусирани върху ролята на вродената имунна клетка на централната нервна система (ЦНС), микроглията. Микроглиално медиираното възпаление се свързва с много симптоми след TBI, включително двигателни дефицити (21), разстройства на настроението (22) и невродегенерация (23). По този начин Microglia предоставя потенциална терапевтична цел за облекчаване на негативните ефекти от невровъзпалението като част от вторично увреждане след TBI.
Микроглиално медиирано невроинфламация след TBI е динамична
Реактивните микроглии са необходими, за да се изчистят отломките и да се модулират синапсите веднага след TBI, но когато са хронично реактивни, могат да бъдат невротоксични. Това става чрез поддържане на оксидативен стрес и невротоксични цитокини като азотен оксид (NO) чрез индуцируема азотна оксидна синтаза (iNOS) (33). NOX2, реактивен кислород (ROS), е силно експресиран в кората на 1 и 2 дни след експериментална CCI при мишки и се локализира с морфологично реактивна микроглия (34). Друго експериментално проучване установи, че CCI при мишки Nox2 -/- води до значително намалено маркиране на CD68, намалена площ на лезията и намалена генна експресия на възпалителни цитокини, включително Il-1β, Il-6 и Tnfα (35). Това показва, че NOX2 е не само цитотоксичен продукт с микроглиална реактивност, но може да взаимодейства с други микроглии, за да поддържа възпалението, медиирано от микроглии. Клиничният анализ на проби от човешки аутопсии от фатални случаи на TBI също показва значително увеличение на експресията на NOX2 в цялата кора в сравнение с контролите (36). Въпреки че е необходима преходна микроглиална реактивност за подходящи имунни реакции при нараняване, персистиращото възпаление е неадаптивно и може да доведе до невронална дегенерация и загуба на клетки.
TBI предизвиква микроглиално грундиране, което допринася за последствията след TBI
Стресът влияе на възпалението чрез глюкокортикоиди
Променено освобождаване на GC влияе на възпалението
Дисфункция на оста на HPA след TBI
Непосредствено след TBI има остро активиране на оста HPA поради стреса на нараняването. TBI с умерен взрив при мишки увеличава циркулиращия CORT веднага след нараняване, което достига връх 3 часа след TBI в сравнение с контролите и се връща към изходното ниво с 5 h след TBI (88). Същото увеличение на активирането на оста на HPA се наблюдава при клинични популации, както едно проучване показа през първите 1-2 дни след лека и умерена TBI, че има значително увеличение на нивата на CORT в циркулиращ спрямо контролите, съответстващи на възрастта (89). Същото клинично проучване показва, че след тежка TBI, изходните серумни нива на CORT намаляват 1–3 дни след TBI. Въпреки че това намаляване на стреса може да намали възпалителните реакции в дългосрочен план след нараняване, потиснатото активиране на оста на HPA може да доведе до влошен резултат след по-тежък TBI.
Причини за потискане на оста след TBI HPA
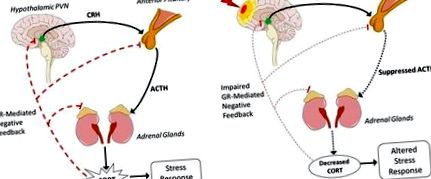
Най-високата честота на пост-TBI HPA аномалии се дължи на дисфункция в предната част на хипофизната жлеза, което води до намалено освобождаване на ACTH и по този начин намалява CORT (Фигура 1B). Хипофизата е особено податлива на TBI и предизвикани от нараняване промени в налягането или кървене. Надлъжните клинични проучвания съобщават за 41% от пациентите с TBI с необичайно високи сутрешни нива на CORT на 10 дни след нараняване (99). До 3 месеца 32% са имали необичайно ниски сутрешни нива на CORT. Тази честота остава относително стабилна на 6 и 12 месеца с анормално ниски нива на CORT, съответно при 37 и 35% от пациентите. Дисфункцията в хипофизата причинява намалено освобождаване на ACTH, като по този начин надбъбречните жлези синтезират и произвеждат по-малко GC. В отговор на това намаление чувствителността на отрицателната обратна връзка се увеличава, за да компенсира. Като такова, повишеното инхибиране може допълнително да намали освобождаването на GC и да предизвика променен отговор на стресорите. Поради сложността на директното, индиректното и регулиране на обратната връзка на всички нива на HPA, все още не е известен един механизъм, чрез който се намалява производството на ACTH.
Усложненията след надбъбречната жлеза след TBI са сравнително редки, тъй като първото клинично проучване е съобщено през 1997 г. (100). Пациентът е приет за рехабилитация 1 месец след TBI поради постоянна слабост, умора и гадене и едва след като не показва значително подобрение при рехабилитация, е извършена ендокринна обработка, която разкрива потиснато освобождаване на GC след прилагане на екзогенен ACTH. В рамките на една седмица след започване на лечение със синтетични GC, преднизон и флудрокортизон, симптомите на замайване и летаргия значително се подобриха. Макар и редки, случаите на надбъбречна недостатъчност чрез увреждане на надбъбречните жлези могат да останат недиагностицирани поради значително припокриване на симптомите само с TBI. Това усложнение често се наблюдава в случаите на множество травми на тялото, които биха могли да доведат до пряко нараняване на надбъбречните жлези и най-често не могат да бъдат пряко приписани на TBI, поради което то обикновено се нарича по-скоро като коморбидност, отколкото като пряк симптом на TBI.
Последици от дисфункцията на оста след TBI HPA
Прекомерното активиране на оста HPA след TBI и неговият ефект върху възстановяването след TBI е добре характеризирано (7, 101). Например, нивата на CORT достигат своя пик след FPI на средната линия при мишки на 30 минути след нараняване и стабилното активиране на оста на HPA продължава, тъй като експресията на CRH иРНК се увеличава с 40% на 2 h след нараняване в сравнение с фиктивните контроли (102). Инхибирането на това повишено активиране на HPA чрез CRH антагонист след 15 минути и 2, 4, 6 и 8 часа след нараняване значително намалява обема на лезията с 45% (103). Това показва прекомерно активиране на оста HPA след TBI увеличава невроналната смърт, което от своя страна може да повлияе на невровъзпалението. Както беше описано по-рано, прекомерните GCs, дължащи се на TBI, също индуцират микроглиално грундиране и увеличават възпалителните цитокини в отговор на стрес, което води до неадаптивно и хронично възпаление.
Възрастта по време на нараняване при възрастни изглежда не влияе на уязвимостта към дисфункция на HPA ос след TBI, тъй като повечето проучвания не съобщават за корелация с възрастта (93). След педиатрична TBI обаче децата под 12-годишна възраст са по-податливи на HPA дисфункция след нараняване в сравнение с по-възрастните юноши (106). В действителност, едно проучване установи, че всички анкетирани деца с лека до тежка TBI са значително потиснали освобождаването на CORT в отговор на активиране на HPA чрез инсулинови тестове (107). Нараняването действа като ранна експозиция на стрес при педиатрична TBI, което може да предизвика неадаптивно съзряване на оста на HPA и по този начин трайно да увеличи податливостта към стрес по-късно в живота (108). В комбинация с променени стресови реакции, дължащи се на дисфункция на оста на HPA, педиатричната TBI може значително да промени нормалното стареене и да допринесе за повишени шансове за психични последствия и намалено качество на живот. Тези данни характеризират нарастваща популация от лица, които остаряват с наранявания и биха могли да бъдат изложени на по-висок риск от развитие на свързани с TBI увреждания поради възраст на нараняване и постоянството на променена реакция на стрес.
Експерименталните модели на стреса дават представа за връзката на дисфункцията, възпалението и резултатите на оста след TBI HPA
Сдържан стрес
Принудително упражнение
Принудително плуване
Крак шок
Стресовите модели следователно влияят на съня
Клинично и експериментално е доказано, че повишеният стрес предизвиква нарушения на съня, дори след като излагането на стрес е преустановено (129). Координацията на освобождаване на GC чрез активиране на оста HPA и сигнали от околната среда е жизненоважна за запазването на нормалното качество на съня и дълголетието. Диференциалната активност на HPA медиира етапите на съня. Хората спят средно 7 до 8 часа през нощта със сън от 6 до 8 часа и изпитват около 6 цикъла на не-REM сън (т.е. сън с бавни вълни) и REM сън (т.е. парадоксален сън) (130). Мишките, от друга страна, спят от 12 до 14 часа по време на леката фаза със сън само от 2 до 4 минути. Освен това те имат многофазен сън, което означава, че те периодично изпитват цикли на не-REM и REM сън с период на будност между тях. Въпреки тези различия в архитектурата на съня, характеристиките на моделите на съня на гризачи като циркадна и хомеостатична модулация на съня са подобни на хората (131) и поради това често се използват в транслационни изследвания.
Нарушаването на съня влошава резултата след TBI
Бъдещи стъпки в доклинични и клинични изследвания на травми
Принос на автора
ZT: написа ръкописа. JG: предостави експертиза по невровъзпаление и редактира ръкописа. OK-C: предостави експертни познания по TBI и редактира ръкописа.
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- 10 храни, които според науката наистина допринасят за дългосрочното здраве
- Brendan Brazier растителна диета може да повиши енергията, да допринесе за благосъстоянието HuffPost Life
- 4 храни за здравословни стави, които намаляват възпалението
- 4 най-лоши храни, които причиняват възпаление Наистина просто
- 10 начина да се отървете от възпалението в червата, според експерти