Николас Бур
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Ричард Дж. Андрюс
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Даниел У. Д. Уест
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Джонатан П Литъл
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Андрю JR Кокран
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Ейми Джей Хектор
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Джошуа Г. А. Кашабек
2 Лаборатория по професионална биомеханика, Катедра по кинезиология, Хамилтън, Онтарио, Канада
Martin J Gibala
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Джеймс Р Потвин
2 Лаборатория по професионална биомеханика, Катедра по кинезиология, Хамилтън, Онтарио, Канада
Стивън К Бейкър
3 Медицински факултет на Майкъл Г. ДеГрут, Катедра по неврология, Университет Макмастър, Хамилтън, Онтарио, Канада
Стюарт М Филипс
1 Изследователска група за метаболизма на упражненията, Хамилтън, Онтарио, Канада
Свързани данни
Резюме
Нетехническо резюме
Еднократно упражнение на съпротива стимулира синтеза на нови мускулни протеини. Хроничното изпълнение на упражнения за съпротива (т.е. тренировка с тежести) е това, което кара мускулите ви да растат по-големи; процес, известен като хипертрофия. Не е известно обаче дали увеличаването на времето, в което мускулите са под напрежение, ще доведе до по-голямо увеличаване на синтеза на мускулен протеин. Ние съобщаваме, че упражнението за удължаване на крака при 30% от най-доброто усилие (което е товар, който е сравнително лек), с бавно повдигащо движение (6 s нагоре и 6 s надолу), изпълнявано до умора, води до по-големи увеличения на синтеза на мускулен протеин отколкото същото движение, извършено бързо (1 s нагоре и 1 s надолу). Тези резултати предполагат, че времето, когато мускулът е под напрежение по време на тренировка, може да бъде важно за оптимизиране на мускулния растеж; това разбиране ни позволява да предписваме по-добре упражнения на тези, които желаят да изградят по-големи мускули и/или да предотвратят загуба на мускули, която се случва при стареене или заболяване.
Резюме
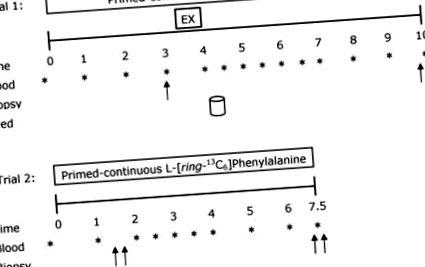
Експериментален протокол
Двойните стрелки показват, че двустранни биопсии са получени в съответните моменти от време. Субектите са консумирали 20 g изолат от суроватъчен протеин по време на хранене.
След приключване на упражнението участниците се върнаха в покой и кръвната проба беше събрана и поставена върху лед. Впоследствие участниците консумираха напитка, съдържаща 20 g изолат от суроватъчен протеин (Fonterra Alacen-895-I, Окланд, Нова Зеландия). Това количество протеин е установено да стимулира максимално скоростта на синтез на мускулен протеин след упражнения за съпротива при млади мъже (Moore et al. 2009a). За да се сведат до минимум нарушенията в изотопното равновесие, напитките се обогатяват до 4% с индикатор съгласно измерено съдържание на фенилаланин от 3,5% в суроватъчния протеин; този подход е обяснен подробно другаде (Burd et al. 2011b). Двустранни биопсии бяха взети на 6 часа след завършване на едностранното упражнение за съпротива. След приключване на проба 1, участниците бяха хранени с храна от кафенето, която представляваше ∼2500–3000 kJ и им беше инструктирано да ядат следващо ястие, което е представително за храненията, които преди това са записали в дневния дневник за хранене. Това хранене трябваше да се консумира не по-късно от 22.00 часа, за да се осигури 10-часово гладуване преди началото на 24-часовото измерване на протеиновия синтез на протеин (опит 2). Участниците бяха инструктирани да се въздържат от физическа активност за вечерта.
На сутринта участниците се върнаха в лабораторията за проба 2 и се подложиха на описаните по-рано процедури за инфузионно изпитване. Двустранни биопсии бяха получени на 1,5 часа след началото на инфузията, последвано от консумацията на обогатена с проследяваща протеин напитка, съдържаща 20 g суроватъчен изолат. Инфузионно изпитване 2 приключи с двустранни биопсии на 6,5 часа. Мускулните биопсии, всички чрез отделни разрези, разделени с ∼4 cm, се извършват с игла на Bergström, която е персонализирана за ръчно всмукване под местна упойка (2% ксилокаин). Всички биопсии са получени от vastus lateralis. Пробите за биопсия се попиват и се освобождават от всякакви видими мазнини и съединителна тъкан, незабавно се замразяват в течен азот и се съхраняват при -80 ° C до по-нататъшен анализ. По време на опити 1 и 2, кръвни проби, взети на всеки 0,5 или 1 час и бяха обработени, както е описано по-рано (Moore et al. 2009a) (Фиг. 1).
Анализи на кръвта
Обогатяването с плазма [пръстен-13 С6] фенилаланин се определя, както е описано по-рано (Glover et al. 2008). Концентрациите на аминокиселини в кръвта се анализират чрез HPLC, както е описано по-рано (Moore et al. 2005). Концентрациите на кръвната глюкоза се анализират с помощта на измервател на кръвната захар (OneTouch Ultra 2, Lifescan Inc., Milpitas, CA, USA) в рамките на 2 минути от вземането на кръв. Плазменият инсулин беше измерен с помощта на наличния в търговската мрежа комплект за имуноанализ (ALPCO Diagnostics, Salem, NH, USA).
Електромиографски анализи
Необработените електромиографски (EMG) сигнали бяха взети на проби при 1024 Hz, като се използва специално направен биоусилвател и бяха събрани със софтуер за придобиване (LabVIEW v 8.2; National Instruments, Austin, TX, USA). Всички сурови EMG сигнали бяха цифровизирани и съхранени на външен твърд диск и анализирани, както беше описано по-рано (Burd et al. 2010a).
Синтез на мускулен протеин
Свободните аминокиселини от обогатени с миофибриларни, митохондриални и саркоплазматични фракции се пречистват с помощта на катионообменна хроматография (смола Dowex 50WX8-200; Sigma-Aldrich Ltd) и се превръщат в техните производни на N-ацетил-n-пропилов естер за анализ чрез изгаряне с газова хроматография- масова спектрометрия с изотопно съотношение (GC-C-IRMS: Hewlett Packard 6890; IRMS модел Delta Plus XP, Thermo Finnagan, Waltham, MA, USA). Мускулните вътреклетъчни аминокиселини бяха извлечени от отделно парче мокър мускул (~ 20 mg) с ледено студено 0,6 m PCA. Мускулът се хомогенизира върху лед с тефлоново покритие и след това се центрофугира при 12 000 g в продължение на 10 минути при 4 ° С. След това супернатантата се събира и този процес се повтаря още два пъти. И трите супернатанта се комбинират и се вземат като вътреклетъчни аминокиселини и се пречистват чрез катионообменна хроматография и се превръщат в техните производни на хептафлуоробутират (HFB) преди анализ с GC-MS (модели 6890 GC и 5973 MS; Hewlett-Packard, Palo Alto, CA, САЩ), както е описано по-рано (Moore et al. 2009b).
Мускулно сигнализиране
Методите за определяне степента на фосфорилиране на Akt на Ser473, mTOR на Ser2448, p70S6K на Thr389, rps6 на Ser240/244, 4EBP1 на Thr37/46, eIF2Bɛ на Ser539, p38 MAPK на Thr180/Try182, Erk1/2 на Thr202/Tyr204, p90RSK на Thr573, rps6 на Ser235/236 и общият протеин бяха извършени, както е описано в предишната ни работа (Burd et al. 2010a). Всички данни се изразяват като съотношение между фосфорилирания към общия протеин и се анализират съответно.
Количествена полимеразна верижна реакция в реално време
Обща РНК е изолирана от мокри мускулни проби (~ 20 mg), както е описано в предишна работа (Cochran et al. 2010). РНК се транскрибира и се провеждат количествени RT-PCR реакции, както е описано по-горе (Cochran et al. 2010). Промяната на сгъване в експресията на PGC-1α се изчислява, използвайки метода ΔΔCt (Livak & Schmittgen, 2001), нормализиран към домакинския ген глицералдехид 3-фосфат дехидрогеназа (GAPDH), който не се променя във времето (P = 0.75). GAPDH праймерите бяха както следва: напред 5′-CCTCCTGCACCACCAACTGCTT-3 ′ и обратен 5′-GAGGGGCCATTCACAGTCTTCT-3 ′.
Изчисления
Фракционните синтетични скорости (FSR) на мускулните протеини бяха изчислени, използвайки стандартното уравнение прекурсор-продукт, както е описано (Moore et al. 2009b; West et al. 2009; Burd et al. 2010a, b). Набирането на „наивно проследяващи“ участници ни позволи да използваме пробата от кръв преди инфузията, която сме измерили като еквивалентна по обогатяване на предиинфузионна биопсия (непубликувана), като обогатяване на изходното ниво преди Ен изчисляването на синтеза на мускулен протеин в покой (бързо). Този подход за единична биопсия за определяне на базалния мускулен протеин FSR е валидиран в нашата лаборатория (Burd et al. 2011b). Нещо повече, този подход е показан за валиден от други, но вместо това работниците са използвали изходна линия (т.е. преди инфузия и по този начин не обогатена) мускулна биопсия (Smith et al. 2010).
Статистика
маса 1
Концентрации на аминокиселини в кръвта, кръвна глюкоза и плазмени концентрации на инсулин на гладно и след поглъщане на 20 g изолат от суроватъчен протеин по време на опит 1 и опит 2
| Опит 1: | |||||||
| Σ EAA (μmol l -1) | 554 ± 34 | 494 ± 44 | 1063 ± 66 * | 1071 ± 95 * | 689 ± 59 | 611 ± 42 | 503 ± 45 |
| Левцин (μmol l -1) | 89 ± 5 | 79 ± 7 | 233 ± 15 * | 249 ± 23 * | 145 ± 13 * | 119 ± 8 | 103 ± 10 |
| Инсулин (μU ml -1) | 4,4 ± 0,9 | 4,3 ± 0,7 | 18,9 ± 0,9 * | 20,9 ± 3,6 * | 6,6 ± 1,3 | 4,4 ± 1,3 | 4,03 ± 0,7 |
| Глюкоза (mm) | 5,0 ± 0,2 | 5,4 ± 0,3 | 5,1 ± 0,1 | 5,3 ± 0,1 | 5,2 ± 0,3 | 5,4 ± 0,1 | 4,9 ± 0,2 |
| Опит 2: | |||||||
| Σ EAA (μmol l -1) | 608 ± 26 | 562 ± 45 | 870 ± 49 | 1197 ± 159 * | 970 ± 110 * | 821 ± 128 | 726 ± 199 |
| Левцин (μmol l -1) | 99 ± 4 | 90 ± 7 | 190 ± 11 * | 221 ± 24 * | 163 ± 16 * | 125 ± 19 | 102 ± 17 |
| Инсулин (μU ml -1) | 4,1 ± 0,6 | 4,2 ± 1,0 | 12,2 ± 2,2 * | 19,2 ± 1,3 * | 6,1 ± 0,6 | 3,4 ± 0,2 | 3,7 ± 0,5 |
| Глюкоза (mm) | 5,3 ± 0,1 | - | 5,3 ± 0,2 | 5,1 ± 0,2 | 4,9 ± 0,2 | 4,9 ± 0,2 | 5,0 ± 0,2 |
Стойностите са средни стойности ± S.E.M. (п = 8). Напитка, съставена от 20 g изолат от суроватъчен протеин. EAA са сбор от His, Ile, Leu, Lys, Met, Phe, Thr, Val (забележка: нито Trp, нито Cys са измерени).
Съотношенията са от отпочинали на гладно и след упражнения за съпротива с бавно (SLOW) или външно работно съвпадение (CTL) мускулно време под напрежение. Стойностите са средни стойности ± S.E.M. Данните се изразяват в произволни единици (AU). * Значително различен от бързия, P 0,05) при фосфорилиране на Erk1/2, p38 MAPK, Akt, mTOR, rps6 на Ser240/244 или 235/236, или eIF2Bɛ (допълнителна фигура).
PGC-1α иРНК
MRNA на PGC-1α се увеличава с ∼ 3 пъти над почивката в 6 h след тренировка, без разлика между условията (основен ефект за времето, P = 0,001) и се връща към изходното ниво с 24 h (фиг. 5).
Въпреки липсата на незабавна стимулация на синтеза на миофибриларен протеин в настоящото проучване, нашите данни предоставят подкрепа, че острите упражнения до неуспех, вероятно чрез максимално активиране на фибрите, водят до забавен сенсибилизиращ ефект върху синтеза на миофибриларен протеин с хранене по време на късното възстановяване на упражненията и предоставят по-нататъшна представа за регулирането на миофибриларния протеинов синтез по време на 24 часа възстановяване при упражнения (Burd et al. 2011a). Повишената чувствителност към хранене с протеини на 24 часа след тренировка, съобщена по-рано (Burd et al. 2011a) и в настоящото проучване, може би не е изненадващо. Тъй като обаче, ако базалните нива на гладно на синтеза на мускулен протеин могат да бъдат повишени до 48 часа (Phillips et al. 1997), тогава индуцираното от храненето потенциране на синтеза на миофибриларен протеин над и над самия отговор на хранене (Moore et al. 2009b) трябва да е очевидно на 24 часа и вероятно дори на 48 часа. Подобни резултати са наблюдавани при възрастни мъже, които, макар и да не могат да постигнат значително повишено хранене в смесения мускулен протеинов синтез при липса на упражнения, показват значително стимулиране на 18 часа след 40 минути ходене (Fujita et al. 2007b).
Трябва да се признае, че методите за изследване на синтеза на мускулни протеини in vivo при хора изискват да се вземат проби от малка популация от мускулни влакна. По този начин се приема, че тази малка популация от влакна е представителна за целия бедронен мускул. Всъщност всички двигателни единици и свързаните с тях влакна от тип I или II в мускула не стрелят едновременно (Sale, 1987). По този начин има селективно набиране на двигатели с бързо и бавно потрепване, за да произведат достатъчно сила за преодоляване на товара. В настоящото проучване използвахме модел, който ни позволи да тестваме как различните нива на набиране засягат специфични протеинови пулове в мускулите. Предполагаме, че мускулните влакна от тип II в крайна сметка са били активирани, което се подкрепя от резултатите на EMG, в условието SLOW, което е довело до някои от по-добрите отговори (Фигури 2 - 4). Разбира се, изучаването на реакцията на нивото на единично влакно би дало ценна представа за това как са засегнати специфични видове влакна по време на упражнения с ниска интензивност. Този подход обаче отчита и малка популация от влакна и осъществимостта на тази методология е трудна за наемане в голям мащаб (изследване на множество времеви точки след тренировка).
- Протеинът наистина ви кара да се чувствате пълноценно време за обучение
- Някои тийнейджъри, които спортуват за изграждане на мускули, може да имат хранителни разстройства Лекар; s Седмично
- Протеинова диета за отслабване без загуба на мускулна маса
- Над 40 Имате нужда от повече протеин за възстановяване на мускулите
- Ново проучване - Яйчните жълтъци също толкова опасни, колкото пушенето (културизъм, хранене, протеини) - Упражнение и