Отдел за ендокринни изследвания, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), Мюнхен, Германия;
Адрес за заявки за повторно отпечатване и друга кореспонденция: M. Bielohuby, Klinikum der Universität München, Medizinische Klinik und Poliklinik IV, Отдел за ендокринни изследвания, Ziemssenstrasse 1, 80336 Мюнхен, Германия (имейл: [имейл защитен]).
Медицински център за детска болница в Синсинати, Синсинати, Охайо;
Институт по метаболитни болести, Медицински колеж, Университет в Синсинати, Синсинати, Охайо;
Център за клинична ветеринарна медицина, Институт по ветеринарна патология, LMU, Мюнхен, Германия;
Отдел за ендокринни изследвания, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), Мюнхен, Германия;
Nephrologisches Zentrum, Medizinische Klinik und Poliklinik IV, Klinikum der LMU, Мюнхен, Германия; и
Отдел за ендокринни изследвания, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), Мюнхен, Германия;
Отдел за ендокринни изследвания, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), Мюнхен, Германия;
Институт за диабет и затлъстяване, Център за здраве и околна среда Helmholtz и Технически университет, Мюнхен, Германия
Център за клинична ветеринарна медицина, Институт по ветеринарна патология, LMU, Мюнхен, Германия;
Институт за диабет и затлъстяване, Център за здраве и околна среда Helmholtz и Технически университет, Мюнхен, Германия
Институт по метаболитни болести, Медицински колеж, Университет в Синсинати, Синсинати, Охайо;
Отдел за ендокринни изследвания, Medizinische Klinik und Poliklinik IV, Klinikum der Ludwig-Maximilians-Universität (LMU), Мюнхен, Германия;
Резюме
Животновъдство
Диетичен състав и диетични групи
Динамични тестове за оценка на толерантността към глюкоза при плъхове с двойно хранене
След 3 седмици на съответните диети плъховете бяха разделени на няколко групи за орални тестове за толерантност към глюкоза (OGTT), интраперитонеални тестове за толерантност към глюкоза (IPGTT) и ITT. За всеки динамичен тест се използва нова група плъхове (5-6 плъхове/диетична група и динамичен тест). За OGTT и IPGTT плъховете се претеглят след 16 до 18 часа бързо. Впоследствие, 2 g/kg телесно тегло, прясно приготвен 50% разтвор на глюкоза се прилага перорално през сонда или игла или се инжектира интраперитонеално (ip). Кръвни проби са получени от вената на опашката на изходно ниво и 15, 30, 60, 120 и 180 минути след предизвикване на глюкоза (допълнително след 5 минути за IPGTT). За ITT плъхове се гладуват в продължение на 6 часа и се инжектират (ip) с 0,75 U инсулин/kg телесно тегло.
Експерименти с хиперинсулинемични евгликемични скоби
Подробно описание на експерименталните процедури е публикувано другаде (45). Накратко, през нощта гладували плъхове са били в съзнание и невъздържани по време на експерименталния период. Сутринта на проучването плъховете бяха претеглени и екстериоризираните катетри бяха удължени за по-лесен достъп. За измерване на кинетиката на глюкозата се прилага чрез предварително калибрирана инфузия с константа (26 μCi) константа (0,26 uCi/min) на високоефективна течна хроматография, пречистена [3- 3 H] глюкоза (Perkin-Elmer Life Sciences, Бостън, Масачузетс) инфузионна помпа (Харвардски апарат, South Natick, MA) при 0–120 минути. На 120–240 минути инфузията на [3- 3 H] глюкоза се увеличава до 0,53 μCi/min, за да се поддържа постоянна специфична активност. От 155–240 минути се прилага грундирана (56 pmol · kg −1 · min -1) непрекъсната (28 pmol · kg −1 · min -1) инфузия на инсулин (Eli Lilly, Indianapolis, IN) чрез предварително калибрирана инфузия помпа (Харвардски апарат). Променлива скорост на 50% инфузия на декстроза поддържа кръвната глюкоза на ∼7,7 mmol/l. По време на експерименталния период се взема кръв на всеки 5–10 минути за измерване на кръвната захар, на всеки 10 минути по време на експерименталния период за [3- 3 H] глюкоза и при по 140 пъти и 240 мин за плазмени нива на инсулин.
Дисекция на плъхове
След 4 седмици на съответните диети, плъховете получиха достъп до храна в продължение на 1 час след изгасване на светлините и след това гладуваха в продължение на 6 часа (за стандартизиране на стомашно-чревния пълнеж) преди обезглавяване под кратка анестезия с изофлуран. Събира се кръв от багажника за по-нататъшен анализ и центрофугираните проби от плазма EDTA се съхраняват при -80 ° C до анализа. Плъховете бяха дисектирани и чернодробни, епидидимни, ингвинални и периренални мастни накладки (само едната страна на всяка мастна подложка) и панкреасът бяха изрязани, внимателно освободени от прилепналите тъкани и претеглени с точност до 0,1 mg (Scaltec Instruments, Goettingen, Германия ). Проби от тъкани на М. gastrocnemius бяха взети и незабавно съхранени върху сух лед (оцветяване с маслено червено О) или незабавно фиксирани в 4% параформалдехид (за експресия на GLUT4). Накрая всички останали органи бяха отстранени и кожата беше подготвена без труп (т.е. чиста маса). След това трупът беше претеглен. Относителните тегла на подложките на черния дроб и мазнините се изчисляват чрез разделяне на теглото на органите на съответното телесно тегло на плъховете. Относителните тегла на контролите са определени на 100%, а теглото на органите на LC-HF групите е изразено като процент от контролите на чау.
Измерване на кръвната глюкоза, липидите и метаболитните хормони в кръвообращението
Всички кръвни проби се обработват, обработват и съхраняват, както е препоръчано по-рано (8). Глюкозата в кръвта на гладно и глюкозата на гладно по време на динамични тестове бяха измерени с помощта на метода на глюкозооксидазата (EcoSolo; Care Diagnostica, Voerde, Германия). Плазмените триглицериди и общият и HDL холестерол се измерват чрез автоматизирана система (Cobas Integra 800; Roche Diagnostics, Манхайм, Германия). Плазменият инсулин, С-пептид (Alpco, Salem, NH), резистин (Bertin Pharma, Montigny le Bretonneux, Франция) и глюкагон (Wako Chemicals, Neuss, Германия) бяха анализирани с помощта на налични в търговската мрежа комплекти (специфични за плъхове) според инструкции на производителя. Общият плазмен глюкозозависим инсулинотропен полипептид (GIP; Merck Millipore, Billerica, MA) беше измерен в проби, стабилизирани с коктейл от протеазен инхибитор (Complete; Roche, Mannheim, Германия) и специфичен инхибитор на дипептидил пептидаза IV (Merck Millipore).
Количествен стереологичен и морфометричен анализ на панкреаса
Откриване на вътремиоцелуларни липиди, съдържание на мускулни триглицериди и скелетна експресия на GLUT4 чрез имунохистохимия
Анализ на експресия на р-р70 S6 киназа
Най - малко 40 μg протеин (извлечен от черен дроб и М. квадрицепс проби) се разтваря чрез SDS-PAGE и след това се прехвърля върху PVDF мембрана, която е била предварително обработена с метанол за 1 min. Мембраните бяха блокирани в разтвор на TBST (буфериран с Tris физиологичен разтвор и 0,1% Tween-20), съдържащ 3% сухо мляко в продължение на 60 минути с постоянно разбъркване. След блокиране, PVDF мембраната се инкубира с първичното заешко антитяло, насочено срещу p-p70 S6 киназа (Thr 389; New England Biolabs, Франкфурт на Майн, Германия) (разреждане 1: 1000 в TBST) за една нощ при 4 ° C. Мембраните се промиват в 10–20 ml TBST (3 пъти в продължение на 5 минути) и се инкубират в продължение на 1 час с конюгирано антитяло от IgG хрян пероксидаза при разреждане 1: 2000 при стайна температура с постоянно разбъркване преди засилена хемилуминесценция (Thermo, Schwerte, Германия) и излагане на филм.
Статистически анализ
Статистическите анализи бяха извършени с помощта на GraphPad Prism (Версия 5; GraphPad Software, La Jolla, CA). За статистическото сравнение между трите диетични групи беше извършен непараметричен ANOVA анализ на Kruskal Wallis с последващи многократни сравнителни тестове на Dunn. P стойности
Таблица 1. Телесно тегло, тегло на органи, липиди в кръвта на гладно и глюкоза, както и плазмени концентрации на хормони при плъхове, хранени с изоенергетични количества от трите различни диети
Данните са представени като средни стойности ± SE. LC-HF-1, 1-ва диета с ниско съдържание на въглехидрати и високо съдържание на мазнини; LC-HF-2, 2-ра диета с ниско съдържание на въглехидрати и високо съдържание на мазнини; GIP, стомашен инхибиторен пептид.
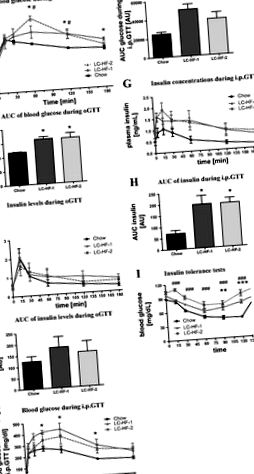
Фиг. 1.Тестове за глюкоза и инсулинов толеранс. Нива на глюкоза в кръвта и плазмен инсулин [и съответната площ под кривата (AUC)] при плъхове, хранени с изоенергетични количества от съответните диети в продължение на 3 седмици по време на орален тест за толерантност към глюкоза (OGTT; A-д) и интраперитонеален тест за толерантност към глюкоза (IPGTT; Е.-З.). Аз: концентрации на глюкоза при плъхове, хранени с изоенергийни количества от съответните диети в продължение на 3 седмици по време на тест за толерантност към инсулин (0,75 U инсулин/kg телесно тегло). Черна, контролна чау (CH) диета; сива и плътна линия, диета в стил „Аткинс“ с ниско съдържание на въглехидрати/високо съдържание на мазнини (LC-HF) (LC-HF-1); сива и пунктирана линия, кетогенна LC-HF-2 диета. Данните са представени като средни стойности ± SE. Различните символи показват значителни разлики в сравнение с контролите, хранени с чау в отделни моменти от време (CH срещу LC-HF-1: *P
Нивата на циркулиращата глюкоза намаляват във всички диетични групи 2 часа след началото на ITT (Фиг. 1Аз). Въпреки това, в сравнение с плъхове, хранени с чау, спадът на глюкозата по време на ITT се забавя значително при плъхове, хранени с LC-HF диета. В допълнение, предизвикването на инсулин доведе до значително по-ниски нива на глюкоза 120 минути след прилагане на инсулин на плъхове, хранени с чау (чау, 42,7 ± 1,7 mg/dl; LC-HF-1, 75 ± 3,6 mg/dl; LC-HF-2, 93,1 ± 6,5 mg/dl). Няма значителна разлика между групите LC-HF-1 и LC-HF-2. Както се очаква, нивата на циркулиращата глюкоза отново се увеличиха във всички групи 6 часа след екзогенното натоварване с инсулин.
Хиперинсулинемични еугликемични скоби.
Постигната е стабилна концентрация на глюкоза при всички плъхове през последните 30 минути от експериментите със скоби (Фиг. 2A). Както се очаква, концентрациите на циркулиращ инсулин бяха увеличени повече от два пъти във всички диетични групи в края на скобата в сравнение с изходното ниво (преди инфузия на инсулин; данните не са показани). Скоростта на вливане на глюкоза е била приблизително три пъти по-висока при плъхове, хранени с чау, в сравнение с двете групи с диета LC-HF, което показва инсулинова резистентност на цялото тяло в групи, хранени с LC-HF (P
Фиг. 2.Хиперинсулинемични еугликемични скоби при плъхове, хранени с изоенергийни количества от съответните диети за 3 седмици. A: концентрации на глюкоза в кръвта по време на хиперинсулинемичните еугликемични скоби. Б.: скорост на инфузия на глюкоза по време на хиперинсулинемичните еугликемични скоби. ° С: промяна в производството на глюкоза. д: глюкозен клирънс. Черно, СН диета; сиво на плътни линии, диета LC-HF-1 в стил Аткинс; сиво на пунктирани линии, кетогенна LC-HF-2 диета. Данните са представени като средни стойности ± SE. * и # Значителни разлики в сравнение с контролите, хранени с чау. *P
Калорично ограничение с LC-HF диети
Както се очакваше, намаляването на дневния енергиен прием на LC-HF диети до 80% от количеството, консумирано от групите, хранени по двойки, доведе до по-ниско телесно тегло в сравнение с групите, хранени с двойки и двойки. Освен това, с ограничение на калориите до 80%, мастната маса и в двете LC-HF диетични групи не се различава от тази на съответните контролни плъхове, хранени с чау (Таблица 2). Концентрациите на глюкоза на гладно и инсулин на гладно бяха допълнително намалени в групите LC-HF с 80% калорично ограничение в сравнение със 100% групите LC-HF, хранени по двойки (Таблица 2). Не са установени значителни разлики в телесното и телесното тегло или в глюкозата и инсулина на гладно между калорично ограничените групи LC-HF-1 и LC-HF-2. По време на OGTT и двете калорично ограничени LC-HF диетични групи показват по-голямо увеличение на максималните концентрации на глюкоза в сравнение с чау. Разликата е особено изразена при плъхове, хранени с LC-HF-2, което също води до значително по-висока AUC за глюкоза по време на OGTT [chow, 12,986 ± 801; LC-HF-1 (80%), 15,662 ± 1,111; LC-HF-2 (80%), 23 809 ± 1 485; CH срещу LC-HF-1 (80%), P = 0,087; CH срещу LC-HF-2 (80%), P
Таблица 2. Телесно тегло, чиста телесна маса, тегло на мазнини и циркулираща кръвна захар на гладно и плазмен инсулин при плъхове, хранени само с 80% от количеството, дадено на двойно хранените LC-HF групи (chow ad libitum)
Данните са представени като средни стойности ± SE.
* P ** P
Фиг. 3.OGTT при плъхове, хранени с 80% от двойно хранените LC-HF диетични групи. Кръвна захар (A) и плазмен инсулин (Б.) концентрации по време на OGTT при плъхове, хранени със съответните LC-HF диети при калорични ограничения (80%) в продължение на 3 седмици (чау, хранени при 100%). Черно, СН диета; сиво на плътни линии, диета LC-HF-1 в стил Аткинс; сиво на пунктирани линии, кетогенна LC-HF-2 диета. Данните са показани като средни стойности ± SE. #P
Морфология на панкреаса и пролиферативен/апоптотичен индекс
Общият обем на панкреаса е по-нисък при LC-HF-1 (−21%, P -6): чау, 1,84 ± 0,76; LC-HF-1, 1 ± 1,23; LC-HF-2, 1,18 ± 1,05; н = 5/група; незначителен]. По същия начин няма значителни разлики в броя на PCNA-положителните ядрени профили на β-клетъчна площ като маркер за пролиферация на β-клетки (chow, 17.3 ± 12.2; LC-HF-1, 11.6 ± 6.2; 2, 22,6 ± 18,5; показани номера × 10 −6; н = 5/група; незначителен).
Фиг. 4.Морфология на панкреаса и островчетата. Обем на панкреаса (A), общ обем на β-клетки (Б.) и обемната плътност на β-клетките в панкреаса (нормализирана спрямо обема и телесното тегло на панкреаса; ° С), определени чрез количествени стереологични методи в участъци на панкреаса от плъхове, хранени с изоенергийни количества от съответните диети за 4 седмици. д: по-ниска β-клетъчна маса при плъхове, хранени с LC-HF диети (кафеникав цвят: инсулин). Черни ленти, CH диета; тъмно сиви ленти, диета LC-HF-1 в стил Аткинс; светлосиви ленти, кетогенна LC-HF-2 диета. ** P
Определяне на вътремиоцелуларни липиди и експресия на GLUT4
Скелетните мускулни участъци (m. Gastrocnemius), оцветени с маслено червено O от плъхове, хранени с двойка LC-HF диетите, изглежда съдържат повече интрамиоцелуларни липиди от тези от плъхове, хранени с чауA). Липидните капчици изглеждаха по-многобройни и по-големи и в двете LC-HF групи. Изолирането на триглицериди от скелетните мускули (m. Gastrocnemius) чрез екстракция на Folch и последващо количествено определяне на по-високи общи концентрации на триглицериди и в двете LC-HF диетични групи, подкрепящи резултатите от анализа на Oil Red O (чау, 15.1 ± 4.0 mg/dl; LC -HF-1, 30,3 ± 2,6 mg/dl; LC-HF-2, 42,8 ± 8,3 mg/dl; чау срещу LC-HF-1: не е значимо; чау срещу LC-HF-2: P
Фиг. 5.A-° С: определяне на вътремиоцелуларни липиди, експресия на GLUT4 в мускулите и чернодробна експресия на p-p70 S6 киназа. A: мускулни секции на плъхове, хранени с двойка изоенергийни количества от 3 различни диети, оцветени за вътремиоцелуларни липиди (Oil Red O). Вътремиоклетъчните липиди се появяват като червени липидни капчици. Б.: GLUT4 се оцветява с Cy3 (червен), разкривайки намалена експресия върху плазмената мембрана и в цитозолните везикули на двете LC-HF групи в сравнение с СН групата. Клетъчните ядра се появяват в синьо (DAPI). ° С: чернодробната експресия на фосфо-p70 S6 киназа е значително по-ниска при плъхове, хранени с LC-HF-1 (LC-1) в сравнение с СН (P
Експресия на p-p70 S6 киназа в черния дроб и мускулите
В сравнение с β-актина, експресията на p-p70 S6 киназа в черния дроб на плъхове, хранени с LC-HF-1, е значително по-ниска в сравнение с чау (P Програма FöFoLe на Медицинския факултет на университета „Лудвиг Максимилианс“, Мюнхен, Германия (грант № 744).
Всички автори декларират, че нямат конфликт на интереси, финансови или по друг начин, за разкриване.
M. Bielohuby, D.A.S., R.W., R.J.S. и M. Bidlingmaier са допринесли за концепцията и дизайна на изследването; M. Bielohuby, S.S., N.H., A.Z., M.F., D.M., B.J.S. и K.S. извърши експериментите; M. Bielohuby, S.S., D.A.S., N.H., D.M., B.J.S., K.S. и M. Bidlingmaier анализираха данните; M. Bielohuby, S.S., D.A.S., N.H., A.Z., B.J.S., R.W., M.H.T., R.J.S. и M. Bidlingmaier интерпретират резултатите от експериментите; M. Bielohuby и S.S. подготвиха фигурите; M. Bielohuby, N.H. и M. Bidlingmaier изготвят ръкописа; M. Bielohuby, M.F., M.H.T., R.J.S. и M. Bidlingmaier редактират и преработват ръкописа; M. Bielohuby, S.S., D.A.S., N.H., A.Z., M.F., D.M., B.J.S., K.S., R.W., M.H.T., R.J.S. и M. Bidlingmaier одобриха окончателната версия на ръкописа.
ПРИЗНАВАНИЯ
Благодарим на Сарина Меурер и Амон Хорнгахер (Medizinische Klinik und Poliklinik IV, Мюнхен, Германия), както и на Лиза Пихл (Институт по ветеринарна патология, Мюнхен, Германия) за отлична техническа помощ. Освен това изказваме благодарността си на Саймън Гар (Medizinische Klinik und Poliklinik IV, Мюнхен) за квалифицирана помощ с Western blots.
- Диети с ниско съдържание на въглехидрати и гликемичен контрол при захарен диабет тип 1 - European Medical Journal
- Нарушена глюкозна толерантност
- Подобрена глюкозна толерантност с високо хранене с въглехидрати при лек диабет; NEJM
- Диетите с ниско съдържание на въглехидрати променят образуването на глюкоза от черния дроб - ScienceDaily
- Как модните диети вредят на вашето здраве - Диета - Здравно списание