Гаафар Рагаб
отделение по ревматология и клинична имунология, Катедра по вътрешни болести, Медицински факултет, Университет в Кайро, Египет
Мохсен Елшахали
b Ревматология, физикална медицина и рехабилитация, Медицински факултет, Университет Суецки канал, Египет
Томас Бардин
c Rhumatologie, болница Lariboisière и Université Paris Diderot Sorbonne Cité, Париж, Франция
Графично резюме
Резюме
Въведение
Подаграта се отличава в историята на Homo sapiens от незапомнени времена. Той се появява в медицинските записи много рано в историята на медицинското писане и също се споменава в биографиите на много известни имена. Тя беше изобразена като съдба на богат живот, колкото и предизвикателството към уменията на лекаря, и наистина беше така. Съвременните епохи са свидетели на забележителен напредък в управлението на подагра. Съвсем наскоро, благодарение на квантовите скокове в молекулярната биология, диагностичните модалности и фармакотерапията, ние се радваме на по-задълбочено разбиране на болестта и по-сложно въоръжение.
Подаграта е системно заболяване, което е резултат от отлагането на мононатриеви уратни кристали (MSU) в тъканите. Повишената серумна пикочна киселина (SUA) над определен праг е изискване за образуването на кристали на пикочна киселина. Въпреки факта, че хиперурикемията е основният патогенен дефект при подагра, много хора с хиперурикемия не развиват подагра и дори не образуват кристали UA. Всъщност само 5% от хората с хиперурикемия над 9 mg/dL развиват подагра. Съответно се смята, че други фактори като генетичната предразположеност участват в честотата на подагра [1], [2].
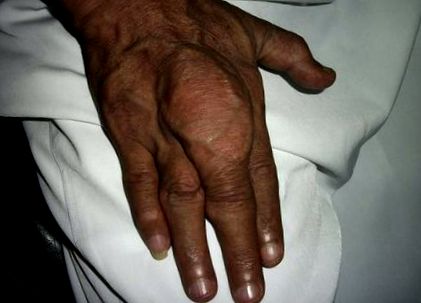
Кристалите MSU могат да се отлагат във всички тъкани главно във и около ставите, образуващи тофи. Подаграта се диагностицира главно чрез идентифициране на патогномоничните кристали на MSU чрез аспирация на ставна течност или в тофи аспират. Ранното представяне на подагра е остро възпаление на ставите, което бързо се облекчава от НСПВС или колхицин. Бъбречните камъни и тофи са късни презентации. Намаляването на нивата на SUA под прага на отлагане, или чрез диетична модификация и използване на лекарства за понижаване на серумната пикочна киселина е основната цел при лечението на подагра. Това води до разтваряне на кристали MSU, предотвратявайки по-нататъшни атаки [3], [4].
Епидемиология
Общото разпространение на подагра е 1–4% от общото население. В западните страни се среща при 3–6% при мъжете и 1–2% при жените. В някои страни разпространението може да се увеличи до 10%. Разпространението нараства до 10% при мъжете и 6% при жените на възраст над 80 години. Годишната честота на подагра е 2,68 на 1000 души. Среща се при мъжете 2–6 пъти повече, отколкото при жените. В световен мащаб честотата на подаграта се увеличава постепенно поради лоши хранителни навици като бързи храни, липса на упражнения, повишена честота на затлъстяване и метаболитен синдром [5].
Патогенеза на хиперурикемия
Уратът е йонизираната форма на пикочна киселина, присъстваща в организма. Пикочната киселина е слаба киселина с рН 5,8. Отлагането на уратни кристали в тъканите започва да се случва, когато нивото на серумната пикочна киселина се повиши над нормалния праг. Патологичният праг на хиперурикемия се определя като 6,8 mg/dL [1], [6].
Някои фактори могат да повлияят на разтворимостта на пикочната киселина в ставата. Те включват рН на синовиалната течност, концентрацията на водата, нивото на електролитите и други синовиални компоненти като протеогликани и колаген. Нивото на SUA в организма се определя от баланса между неговото производство или от прием на пурин в диетата, или от ендогенно производство чрез клетъчен оборот и екскрецията му чрез бъбреците и GIT. Повишеното производство на UA носи отговорност само за 10% от случаите на подагра, докато останалите 90% са причинени от недостатъчната му екскреция в бъбреците [7].
Факторите, влияещи върху нивата на SUA, включват възраст и пол. SUA е ниско при децата. След пубертета нивата на SUA започват да се увеличават, за да достигнат нормалните си нива. При мъжете нивата са по-високи, отколкото при жените. Нивата на SUA при жените в постменопауза се увеличават, за да достигнат нивата на мъжете. Това обяснява защо подаграта обикновено е заболяване на мъжете на средна възраст и по-възрастните и жените в постменопауза. Рядко това може да се случи при деца и млади хора при някои редки вродени грешки в метаболизма на пурините. Тези ензимни дефекти водят до увеличаване на SUA с последващо производство на кристали UA в бъбреците и ставите (фиг. 1) [8].
Патогенеза на хиперурикемия (възприета и проектирана от д-р EL-Shahaly).
Свръхпроизводство на пикочна киселина
Недостигът на ензими, участващи в пуриновия метаболизъм, води до свръхпроизводство на UA. Например, синдромът на Lesch-Nyhan е вродена грешка в метаболизма в резултат на дефицит на ензим, участващ в метаболизма на UA, наречен хипоксантин-гуанин фосфорибозилтрансфераза. Това е генетично X-свързано рецесивно разстройство с различна степен на тежест според вида мутация. Клиничната картина на това заболяване включва неврологични аномалии като дистония, хорея, когнитивна дисфункция, компулсивно увреждащо поведение, саморазправа и ставни прояви (подагра с ранно начало) в допълнение към бъбречните камъни. Ако не се лекува, това може да доведе до образуване на тофи и бъбречна недостатъчност [9].
Друга ензимна аномалия, която причинява подагра при младите, е свръхактивността на фосфорибозил пирофосфат синтетазата. Това е Х-свързано доминиращо наследствено разстройство. Синдромът има две клинични форми, тежка форма на ранно начало при деца и лека форма на късно младежка или ранна форма на възрастни. Клиничната картина включва неврологични аномалии като сензоневрална загуба на слуха, хипотония и атаксия в тежка форма. Леката форма се проявява като камъни в пикочната киселина в бъбреците и артрит. Тези ензимни нарушения обаче представляват само по-малко от 10% от случаите на свръхпроизводство на урати [10].
Поглъщането на храни, богати на пурини като варени или преработени храни, особено от животински и морски произход, е ключов елемент за увеличаване на прекурсорите на пикочна киселина. Докато храни, богати на пурин от растителен произход като боб, леща, гъби, грах, бобови растения и млечни продукти, не носят никакъв риск от хиперурикемия и подагра, следователно могат да бъдат разрешени при пациенти с подагра. Освен това храни, богати на витамин С, млечни продукти с ниско съдържание на мазнини, растителни масла като маслини, слънчоглед и соя са свързани с намален риск от хиперурикемия и подагра. Установено е, че витамин С увеличава бъбречната екскреция на пикочна киселина, така че може да се използва като добавка по време на лечение на подагра [11], [12].
Алкохолът е добре известен рисков фактор за подагра. Проучванията показват, че консумацията на алкохол е свързана с консумираното количество. Освен това рискът от подагра и хиперурикемия зависи от вида на различните алкохолни напитки. Например бирата е най-лошата при увеличаване на риска от подагра в сравнение с алкохола. Докато най-ниският риск сред алкохолните напитки е бил за виното [11].
Ендогенно производство на урат
Повишеното ендогенно производство на пикочна киселина се случва при ускорен клетъчен оборот, като например при злокачествени заболявания, хематологични и възпалителни заболявания. Също така, повишеното производство на пурин може да е резултат от химиотерапия и увреждане на тъканите. Освен това, повишеното телесно тегло и затлъстяването води до засилено производство на пикочна киселина, влошаващо риска от хиперурикемия. Установено е, че лептинът повишава серумните нива на урат. Така че, отслабването и упражненията са много полезни за намаляване на нивата на SUA и риска от подагра [13], [14], [15], [16].
Намалено отделяне на пикочна киселина
Две трети от екскрецията на урат се случва в бъбреците, докато останалата част се екскретира през стомашно-чревния тракт (GIT). Намалената секреторна функция на транспортера ABCG2 води до намалена екскреция на пикочна киселина през GIT, което води до повишаване на серумните нива на пикочна киселина и засилена бъбречна екскреция [7], [17].
Кристалите на пикочната киселина не са разтворими, така че изискват специфични мембранни транспортери, за да преминат през клетъчните мембрани. От тези транспортери са уратният транспортер/канал (URAT) главно URAT1 и органичните анионни транспортери (OAT1 и OAT3) [7], [18].
Бъбречната екскреция на пикочна киселина е крайният резултат от 4 фази. Първата фаза е преминаването на UA през капсулата на Bowman (гломерулна филтрация); последвано от реабсорбция на почти всички урати, преминаващи в проксималните тубули. Третата фаза включва секреция на част от реабсорбирания UA, завършващ с друга фаза на реабсорбция в проксималните тубули. Екскретираният UA е почти 10% от филтрирания урат през капсулата на Bowman, а останалата част се реабсорбира в тялото (фиг. 2) [19].
Бъбречна екскреция на пикочна киселина (възприета и проектирана от д-р EL-Shahaly).
Намалената бъбречна екскреция на урат е свързана с някои автозомно-доминантни нарушения. Уромодулинът е ген, който се изразява в дебелия възходящ крайник на примката на кокошката. Той отговаря за регулирането на водопропускливостта. Мутациите на уромодулиновия ген водят до намалена фракционна екскреция на UA, което от своя страна увеличава SUA [20].
URAT1 транспортира UA във филтрирана течност, преминаваща през проксималните тубули в тубулулите чрез активен транспортен процес. Урикозуричните лекарства като пробенецид, бензбромарон и сулфинпиразон намаляват активността на URAT1 и съответно реабсорбцията на UA в проксималните тубули. От друга страна, лекарства като пиразинамид, никотинат и лактат увеличават реабсорбцията на урат чрез въздействие върху URAT1, премествайки UA от лумена в тръбните клетки. И двете увеличават гломерулната филтрация и тубулната реабсорбция на UA, предотвратявайки загубата му в урината и увеличавайки нивата на UA в серума [21].
Веществата, които оказват влияние върху активността на URAT1, могат едновременно да усилят или инхибират неговата активност в зависимост от тяхната доза. Например, ниските дози аспирин имат антиурикозуричен ефект, докато високите дози имат урикозуричен ефект. Високите дози аспирин инхибират URAT1, оттук и неговият урикозуричен ефект. Този процес се нарича цис-инхибиране на URAT1. Антиурикозуричният ефект се причинява от транс-стимулация на URAT1 от аспирин [22].
Гени, отговорни за регулирането на пикочната киселина
Генът SLC22A12 кодира за транспортера URAT1, присъстващ върху апикалната мембрана на бъбречните тубули. SLC2A9 е друг ген, участващ в регулирането на екскрецията на UA. Той кодира за транспортен протеин в мембраната на бъбречните тубули. Полиморфизмът на двата гена води до намалена фракционна екскреция на UA, което води до повишени нива на SUA. ABCG2 е транспортер на ген за UA в проксималните тубуларни клетки на бъбреците, както и в GIT. Гените SLC17A1, SLC17A3 са важни детерминанти на нивата на SUA, действащи като мембранни транспортери в детските. Други гени, участващи в определянето на нивата на SUA, включват SLC22A11, глюкокиназния регулаторен протеин (GCKR), Carmil (LRRC16A) и близо до PDZ домейн, съдържащ 1 (PDZK1) гени [23], [24].
Патогенеза на остър подагрозен артрит
Отлагането на кристали UA в ставната кухина е причината за подагра. Тези кристали инициират възпалителния процес чрез поглъщане от синовиални фагоцитни клетки, което води до освобождаване на лизозомни ензими и производство на възпалителни хемокини. Друг механизъм е, че кристалите UA променят стабилността на клетъчната мембрана на фагоцитните клетки чрез директно омрежване с мембранни липиди и гликопротеини. Това включва задействането на G протеин, фосфолипаза А2, С и D, тирозин киназа и други кинази като митоген-активирани кинази (ERK1/ERK2, p38) и c-Jun N-терминална киназа. Това взаимодействие води до повишен IL-8 във фагоцитите, което води до активиране на неутрофилите [25], [26].
Патогенезата на подагричния артрит включва първоначално активиране на моноцити и мастоцити, последвано от неутрофили. Преди първата атака на подагра и в междукритичния период макрофагите поглъщат кристали UA. Добре диференцираните макрофаги имат способността да съдържат тези кристали, без да предизвикват възпалителен отговор. Докато по-малко диференцираните моноцити произвеждат изобилие от TNF, IL-1, IL-6 и IL-8 заедно с ендотелна активация след фагоцитоза на уратни кристали. Също така, мастоцитите са ключови играчи при предизвикването на остра подагрична атака, като произвеждат хистамин и IL-1. Това води до увеличаване на съдовата пропускливост и вазодилатация. Интересното е, че се смята, че дори може да сложи край на възпалителната фаза чрез поглъщане на кристалите и възпалителните отломки [26], [27].
Хемотаксичните фактори, произведени от моноцити и мастоцити и локалната вазодилатация стимулира неутрофилния хемотаксис. Също така, активирането на ендотелните клетки допълнително влошава възпалителния отговор и миграцията на неутрофилите. Това води до приток на неутрофили на местно ниво. Смята се, че колхицинът действа чрез спиране на острата атака чрез промяна на афинитета на селектините върху ендотелните клетки и неутрофилите към възпалителни медиатори, а също и чрез блокиране на неутрофилната стимулация, индуцирана от ендотелните клетки [28], [29].
Вътре в синовиума изобилието от хемотаксични фактори като левкотриени, фактор за активиране на тромбоцитите и интерлевкини основно IL-8 е отговорно за 90% от активирането на неутрофилите и обостряне на острото възпаление. Съответно насочването към IL-8 може да бъде обещаващо за спиране на острата атака на подагра [26].
Острата атака на подагра обикновено е самоограничена. Разтваря се в рамките на часове до няколко дни от началото му. Това се случва чрез отстраняване и фагоцитоза на кристали от макрофаги, като по този начин се потиска клетъчното и хемокиновото активиране. Също така, макрофагите изчистват клетъчните апоптотични остатъци, за да помогнат за спиране на възпалителната каскада. Освен това макрофагите секретират TGF-β, който елиминира IL-1, друг ключов играч за засилване на възпалителния процес [30].
Противовъзпалителните цитокини играят важна роля за инхибиране на възпалителния процес. Други механизми, участващи в прекратяването на острата атака, включват протеолиза на провъзпалителни цитокини, намаляване на експресията на рецептори за TNFα и интерлевкини на повърхността на левкоцитите. Вазодилатацията и повишената съдова пропускливост също са важни, за да позволят екстравазацията на макрофаги в синовиалната течност, за да се изчисти възпалителната зона (фиг. 3) [30].
- Симптоми на подагра, причини, лечения и връзка с бъбречната болест - Американски бъбречен фонд (AKF)
- Болка при подагра Подутият ми глезен се оказа; Болест на царете;
- Глутен-чувствителна цьолиакия тук; s Защо определено ТРЯБВА да обмислите да ядете тези ферментирали
- Съвременни средства за хемороиди при древна болест
- Преглед на диетата с гликемично натоварване за 2020 г. - Rip-Off или си струва да опитате Ето защо