Резюме
Въведение
Антисенс олигонуклеотидите (АО) имат способността да модулират генната експресия чрез взаимодействие със специфични генни транскрипти чрез различни механизми. Преди десетилетия бяха направени амбициозни твърдения относно потенциала на AO технологията за модулиране на генната експресия при лечението на човешки заболявания, но с повечето нови платформи за откриване на лекарства, различни фактори, включително непоследователни синтезни протоколи, неадекватно разбиране на механизмите и ограничен експериментален контрол, възпрепятстват технологичния напредък. Към днешна дата само шепа АО са одобрени за клинична употреба, въпреки годините на клинично развитие, и от заден план е забележително, че всяко одобрено лечение се позовава на различен механизъм на действие [1].
Наскоро бяха одобрени две нови лекарства за лечение на две „често срещани“ редки и тежки генетични заболявания: мускулна дистрофия на Дюшен (DMD) [2] и спинална мускулна атрофия (SMA) [3]. И в двата случая намесата е предназначена за пренасочване на пре-мРНК обработка, в случай на DMD, чрез индукция на целенасочено прескачане на екзон, докато при SMA целта е да се насърчи задържането на екзон, за да се получи функционален транскрипт. Всички човешки гени се подлагат на някаква форма на пре-мРНК обработка по време на експресия и по-голямата част от първичните генни транскрипти се подлагат или на конститутивно, или на алтернативно сплайсинг, при което некодиращите интронни последователности се отстраняват от зрялата иРНК и екзоните се преплитат точно заедно. Мутациите, които причиняват необичайно снаждане, пълна или частична загуба на екзон или задържане на интронни последователности, сега се признават като относително чести причини за човешко заболяване [4]. Следователно потенциалът за AO модификация на генната експресия като терапевтична стратегия в момента се изследва в други условия на заболяването.
Енергичните изследвания се фокусират върху усъвършенстването на химическите вещества и модификациите на АО за подобряване на бионаличността, безопасността, потентността и намаляване на нецелевите ефекти [5,6,7]. Въпреки това, предизвикателствата пред клиничния превод на тази технология все още съществуват, особено по отношение на ефективното доставяне и ядреното усвояване на АО в прицелните тъкани и ще варират в зависимост от прицелната тъкан и заболяването. В допълнение, клиничното изпитване и оценка на нови терапевтични средства в условия, при които популацията от пациенти е малка и прогресията на заболяването е бавна, най-вероятно ще изисква иновативни и адаптивни проучвания [8,9,10,11]. В този преглед ние предлагаме уводен преглед на АО химиите, механизмите и предимствата на всеки с особено внимание към потенциала за лечение на респираторни заболявания от генетичен произход.
Преглед
Антисенс химия на олигонуклеотидите
Антисенс олигонуклеотидите са къси, единични нишки нуклеинова киселина, които обикновено се цитират с дължина 13-50 нуклеотиди, но на практика по-често са с дължина 20-25 бази. Подходящо проектирани съединения могат да се свързват с висок афинитет и специфичност към дадени нуклеинови киселинни мишени чрез сдвояване на основите на Уотсън и Крик [12]. Тъй като естественият фосфодиестерен скелет на РНК и ДНК е особено податлив на деградация на нуклеаза, химията, използвана за всеки нуклеотид в ранни проучвания, в които са използвани АО, е нестабилна и като цяло неефективна. Това ограничение беше бързо разпознато и бяха направени химически модификации на олигонуклеотидния скелет, целящи подобряване на афинитета на целта, устойчивостта на нуклеаза, токсикологичния профил, биостабилността и фармакокинетиката [13,14,15,16,17,18,19,20,21] . Към днешна дата са създадени голямо разнообразие от аналози на АО, които се различават по своите фармакологични свойства и те допълнително допринасят за механизмите на действие [5]. Химията на определени аналози на АО е разгледана задълбочено другаде [15,16,17] и няма да бъде обсъждана подробно в този преглед. Свойствата на често използваните нуклеотидни химикали, които се използват за формулиране на АО, са обобщени в таблица 1.
Използване на антисенс терапия при заболяване
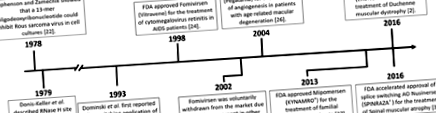
Основен график за развитието и клиничното използване на антисенс олигонуклеотиди
Горните примери използват АО за промяна на генната експресия, директно или чрез конкурентно свързване с рецепторите, за промяна на прогресията на заболяването. Друг прецизен метод за промяна на прогресията на заболяването е манипулирането на сплайсинг на екзони в рамките на генна транскрипция, използвайки AO за превключване на сплайсинга. Първият докладван пример за AO-медиирано превключване на сплайси е съобщено от Dominski и Kole през 1993 г., които използват AOs, за да коригират анормалното снаждане на β-глобинов транскрипт, отговорен за бета-таласемията. Това първоначално е направено in vitro с векторни конструкции и безклетъчни екстракти [28], а по-късно и в периферни кръвни клетки [29], но все още не е преминало към клинични изпитвания. Терапевтичните интервенции, които използват алтернативно снаждане, се изследват и при заболявания като ангиопластична рестеноза [30], рак [31, 32], амиотрофична странична склероза [7, 33] и болест на Хънтингтън [34].
DMD е X-свързано рецесивно разхищение на мускулите, причинено от мутации в DMD ген, които водят до преждевременно прекратяване на транслацията [35]. По-леката форма на заболяването, мускулната дистрофия на Бекер (КМП), обикновено се причинява от заличавания в рамката в гена на дистрофин, които водят до вътрешно пресечен дистрофинов протеин, който запазва частична функция. Обосновката на терапията за превключване на сплайсинга за DMD е да се пренасочи обработването на дистрофин преди mRNA и да се индуцира подобна на BMD дистрофин mRNA, която ще бъде трансформирана в протеин, който запазва определено ниво на функция и по този начин ще намали тежестта на заболяването. Exondys 51 е специално разработен за справяне с най-често срещаната подгрупа на DMD мутации, избрани геномни делеции, обграждащи екзон 51, и ще бъде от значение за приблизително 13% от пациентите с делеция на DMD (Фиг. 2). Момчетата, които са получавали Exondys 51, остават амбулантни и имат намален спад на дихателните мускули в сравнение с историческите данни [36]. Последните клинични проучвания фаза 1/2 с голодирсен, разработени за пропускане на екзон 53 при DMD, показват 10-кратно увеличение на експресията на дистрофинов протеин в мускулни проби след 48 седмици лечение [37], като продължават проучвания фаза 3 (NCT02500381).
Exondys 51 ™ изключва дистрофин екзон 51 и коригира DMD рамка за четене, поради което се намалява тежестта на заболяването при най-често срещания тип мутация на DMD. а Нормално снаждане на DMD екзони 49–52. б Exon 51 се изтрива от DMD транскрипт в резултат на мутация при засяга около 13% от пациентите с DMD. Exondys 51 променя сплайсинга на екзон 51, премахвайки го от DMD препис, възстановяване на рамката за четене и намаляване на тежестта на заболяването, отразяващо фенотип на Becker MD
Различните мутации, причиняващи DMD, изискват други стратегии за превключване на сплайсирането, за да се преработи дистрофиновата иРНК и поне пет допълнителни съединения, насочени към екзони 51, 53, 46, 50 и 43, биха отговорили на до 43% от мутациите на DMD [38]. За допълнително увеличаване на спектъра от мутации, които могат да бъдат насочени, множество АО могат да бъдат комбинирани като коктейл за насочване на блокове от последователни екзони [39]. В допълнение към увеличения обхват на мутациите, които могат да бъдат насочени, успешни комбинации от множество пропускащи екзони могат да бъдат приложени към по-широк набор от пациенти. Тази стратегия е разработена за няколко мутации в DMD, но тепърва ще бъде преведена [39,40,41]. Предлага се също така да се пропуснат екзони 45–55 от DMD ген може да доведе до функционална протеинова изоформа и да спаси до 63% от пациентите с DMD [42].
SMA е фатално автозомно-рецесивно нервно-мускулно заболяване, което води до прогресивна парализа с мускулна атрофия през първите години от живота [43]. Оцеляване на моторния неврон (SMN) 1 и SMN2 гени кодират SMN протеина и въпреки че и двата гена потенциално кодират идентични протеини, C> T полиморфизмът в третата основа на глицинов кодон в екзон 7 нарушава нормалната обработка на SMN2, такъв, че екзон 7 е пропуснат от по-голямата част от стенограмите. SMA се причинява от хомозиготна загуба на SMN1 ген и неспособност на две копия на SMN2 за компенсиране на производството на протеини поради неефективно снаждане на екзон 7 [44]. AO за превключване на сплайсинг е разработен, за да се насочи към SMN2 интронен елемент на шумозаглушител ISS-N1 и насърчава включването на екзон 7, като по този начин позволява SMN2 за да се получи пълноценен и функционален SMA протеин [45] (фиг. 3). През 2016 г. терапевтичният AO за превключване на снаждане, нусинерсен (SPINRAZA®), беше одобрен от FDA [46]. Nusinersen се инжектира интратекално при пациенти веднага щом се потвърди диагнозата SMA. Nusinersen увеличава нивата на SMN протеин в гръбначния мозък в пълна дължина, поради което подобрява двигателната функция при пациенти с SMA и вероятно удължава продължителността на живота [47].
SPINRAZA® засилва разпознаването и задържането на екзон 7 в SMN2 иРНК транскрипт, намалявайки тежестта на SMA заболяването. а Преобладаващо снаждане на SMN2 екзони 6–9. б Екзоничният полиморфизъм отслабва селекцията на екзон 7 в SMN2 иРНК. SPINRAZA® засилва селекцията на exon 7 в SMN2 транскрипт, произвеждащ функционален протеин и намалява тежестта на SMA заболяването
Потенциал на антисенс олигонуклеотидна терапия при CF
Потенциална терапевтична стратегия за намаляване на тежестта на CF болестта е да се определи коя от
В допълнение към стратегиите за прескачане на екзон, част от вариациите на последователността и синонимните промени могат да отслабят сплайсинга, компрометирайки избора и задържането на екзон в зрялата иРНК и по този начин да допринесат за тежестта на заболяването. Вредно алтернативно снаждане на CFTR екзон 10, медииран от интронни полиморфизми, е докладван като причина за МВ при подгрупа пациенти [57,58,59]. AO могат да се използват за засилване на задържането на CFTR екзон 10 в зрялата иРНК и би могъл да повлияе на проявата на заболяването при пациенти с различни мутации или да се използва за допълване на алтернативни стратегии чрез увеличаване на нивата на иРНК (фиг. 4). Пример in vitro е мутация на сплайсинг CFTR 2657 + 5G> Мутация, която води до изключване на екзон 16 по време на сплайсинг; преписът обаче е коригиран от AO, предназначен да засили включването на екзон 16 [60]. Мутация, открита при 5% от еврейските пациенти в Ашкенази, 3849 + 10 kb C → T, създава ново донорно място в интрон 19, което кара псевдо-екзон от 84 базови двойки да бъде включен в иРНК и генериране на преждевременен стоп кодон [61,62,63]. In vitro корекция на този дефект на сплайсинг с използване на АО е постигната през 1999 г. от Friedman et al .; все още няма клинично приложение [62].
Вредно алтернативно снаждане на CFTR exon 10 може да бъде адресиран с помощта на AO за превключване на снаждане. а Нормално снаждане на екзони 9–11 от CFTR. б Вътрешният полиморфизъм отслабва селекцията на екзон 10 в CFTR иРНК. АО-медиирано задържане на CFTR екзон 10 в зрялата иРНК
Антисенс олигонуклеотидна терапия за лечение на нарушения на метаболизма на сърфактант протеин
Сплайс мутация в ABCA3 причинява частично включване на интрон 25 в иРНК, което води до DSPM. а Нормално сплайсинг на ABCA3 екзони 24–26. б Аберантно сплайсинг на интрон 25, причинен от точкова мутация, IVS-98T, въвежда стоп кодон след 77 допълнителни аминокиселини след екзон 25, което води до пресечен протеин. АО-медиирана корекция на снаждане може потенциално да намали тежестта на заболяването
По-голямата част от болестотворните мутации в SFTPC са открити в домейна BRICHOS (екзони 4 и 5) на пропептида SP-C, включително първия докладван SFTPC мутация, c.460 + 1 G, което води до пропускане на екзон 4 поради загуба на каноничното място за снаждане на донора [76]. Мутациите в BRICHOS домейна на SP-C водят до неправилно нагъване на протеини и цитозолно натрупване на аберантен протеин, с доминиращ отрицателен ефект [77]. За заболяване, свързано с токсична печалба на функция, свързана с определени SFTPC мутации [78], AOs потенциално могат да бъдат използвани за намаляване на нивата на анормални SP-C протеини, ако е възможно специфично алелно заглушаване.
Осигуряване на антисенс олигонуклеотидна терапия
Едно от основните предизвикателства при разработването на терапии, базирани на АО, е да се постигне ефективно доставяне до съответната за болестта тъкан in vivo и в допълнение да се преодолеят клетъчните бариери, които пречат на АО да достигнат вътреклетъчни молекулярни цели в ядрото, където се извършва сплайсинг. В допълнение, AO интервенцията позволява само временна корекция на анормална генна експресия или сплайсинг, което прави разработването на подходящи режими на дозиране и приложение на лекарството първостепенно.
Различни стратегии, които могат да бъдат използвани за подобряване на доставката на АО, също влияят върху разпределението на тъканите и биологичните действия на АО, в сравнение с доставката на „свободни“ олигонуклеотиди. Тези методи могат да включват използването на молекули носители, конюгиране и/или съвместно приложение с други фактори. Една такава стратегия е да се включи АО или в липиден [88, 89], или в полимерен [90] наноносител, за да се насърчи клетъчното поемане и да се улесни ендозомното освобождаване. Липидните наноносители, за in vivo употреба, имат повърхностно покритие (като полиетилен гликол), което намалява разпознаването и поемането на наноносителя от макрофаги [91], докато катионните липиди в частицата позволяват на АО да излязат от ендозомата след ендоцитоза в целта клетка. Токсичността, приписвана на ефекта на катионните липиди върху клетъчните мембрани, поражда съмнения относно клиничната употреба на липидни наноносители [92]. Обикновено както липидните, така и полимерните наночастици имат ограничено биоразпределение поради относително големия си размер (
100 nm), което поражда допълнителни опасения относно токсичността [92].
Друга стратегия е да се модифицира АО чрез конюгиране към определени лиганди като липиди [93], въглехидрати, пептиди [94] или аптамери [95]. Биоразпределението на конюгирани олигонуклеотиди е по-малко ограничено от тези, комплексирани към наноносители, и конюгатите могат лесно да преминат през капилярната ендотелна бариера. По същия начин потенциалът за токсичност изглежда по-нисък, отколкото за наноносителите [90]. Конюгираните олигонуклеотиди също имат потенциал за селективно насочване към широк спектър от специфични тъканни рецептори като интегрини, тол-подобни рецептори или рецепторни тирозин кинази [92]. Конюгация с н-ацетилгалактозаминът е широко използван за подобряване на доставката на олигонуклеотиди до хепатоцитите [15]. Въпреки това, за разлика от наноносителите, конюгатите са обект на бърз бъбречен клирънс поради малкия си размер, ограничавайки тяхната бионаличност.
Ефективността на доставката може също да се подобри чрез съвместно прилагане на определени фактори с AO. В проучване при мишки, индуцираната от АО експресия на трансгена се подобрява, когато специфичен 2 '-О-метил РНК се инжектира интрамускулно заедно с нейонен блок кополимер, F127 [96]. Освен това проучвания в DMD mdx модел на мишка демонстрира, че клетъчното усвояване на PMO се засилва от едновременното прилагане на глюкозо-фруктозна формулировка, което води до възстановяване на по-високи нива на дистрофинов протеин в скелетните мускули [97].
Не само терапевтичният ефект на АО зависи от достигането на прицелната клетка, АО трябва да достигне и вътреклетъчни молекулярни цели. Интернализирането на АО на клетъчната повърхност може да се осъществи по множество пътища и може да зависи от клетъчния тип и физиологичното състояние на клетката [98]. Ендоцитозата на АО обаче не гарантира доставка до вътреклетъчни целеви места, тъй като те първо трябва да избягат от свързаните с мембраната вътреклетъчни отделения [92]. Съдържанието на ендозомите, включително вътрешните АО, са насочени до голяма степен към лизозомите за разграждане или към плазмената мембрана за експулсиране към клетъчната външност, където те не са в състояние да изпълнят терапевтичната си функция. Широко разпространено е мнението, че ендозомната бариера за бягство е една от най-значимите пречки пред ефективното използване на АО в терапевтичните средства [92].
Заключения
- Хранителната среда, нейните ефекти върху диетичната консумация и потенциал за измерване вътре
- Защо само някои затлъстели хора развиват хронични заболявания Болестни мастни клетки, открити при тези с
- Симптоми на панкреатични заболявания
- Този нов документален филм хвърля светлина върху това, което всъщност е необходимо за борба с детското затлъстяване HuffPost Life
- Използване на реални данни за оценка на връзката на базирани на инкретин терапии с риск от остри заболявания