Вивек Матю
Катедра по ендокринология, Медицински колеж и болница Сейнт Джон, Сарджапур Роуд, Бангалор, Карнатака, Индия
S. Vageesh Ayyar
Катедра по ендокринология, Медицински колеж и болница Сейнт Джон, Сарджапур Роуд, Бангалор, Карнатака, Индия
Резюме
Съществуват значителни доказателства за факта, че средата на ранен живот при хората е свързана с бъдещото развитие на различни метаболитни заболявания. Изглежда, че феталното програмиране и перинаталните събития оказват влияние върху по-късния живот, независимо от рисковите фактори на околната среда при възрастни. Нашето разбиране за основните механизми е ограничено и остава неясно. Въпреки това няколко животински модела и епидемиологични проучвания показват тази връзка и се предполага, че е вторична спрямо санкциите за пластичност на развитието. В този преглед обединяваме факти от няколко дисциплини в подкрепа на тази хипотеза.
„Дяволът е наложил наказание за всички неща, на които се радваме в живота. Или страдаме в здраве, или страдаме в душа, или дебелееме. "
ЗАДЕН ПЛАН
Инсулиновата резистентност, ключовият компонент на захарен диабет тип 2 (T2DM), е свързана с множество заболявания като затлъстяване, хипертония, коронарна артериална болест (CAD) и дислипидемия. Тези заболявания оказват голямо влияние върху ресурсите по целия свят с големи последици за физическото, психологическото и финансовото благосъстояние. Прогнозира се, че разпространението на диабета ще бъде 7,7% през 2030 г., засягайки 439 милиона възрастни. [1] Огромността на проблема наложи пренасочване на фокуса от лечението на диабета и свързаните с него заболявания към първичната профилактика. Вътрематочната среда предоставя на индивида кратък преглед на условията, на които човек може да бъде изложен по време на детския растеж и живота на възрастните. Тази информация от своя страна води до адаптивна реакция в метаболизма, която осигурява предимство за оцеляване. Някои брилянтни епидемиологични проучвания от втората част на миналия век са допринесли за установяването на връзката между размера на тялото при раждането и различни заболявания на възрастните, включително диабет и сърдечно-съдови заболявания. В тази статия се опитахме да дадем изчерпателен преглед на съществуващата литература за произхода на болестта при възрастни (DOAD).
Е ПИДЕМИОЛОГИЧНО Е ВИДЕНИЕ
Ниското тегло при раждане постоянно се свързва с диабет при възрастни в различна публикувана литература от развития свят и Азия. [11–14] Изследване, направено от Майсур в Южна Индия, предполага, че по-късата дължина на тялото и по-високият пондерален индекс при раждането са свързани с IGT и диабет тип 2 на 45-годишна възраст, докато ниското тегло при раждане не е било [15]. Теглото при раждане от своя страна зависи от различни фактори като храненето на майката, паритета, теглото при раждане на майката, размера на възрастния на майката и теглото при раждане на майката. [16]
Г ЕНЕТИЧНИ М ЕХАНИЗМИ В РАЗВИТИЕТО НА РАЗВИТИЕТО НА ДЪРНАТА Д ИЗБОР
Сложните взаимодействия на околната среда и храненето с генотипите на майката и плода влияят върху благосъстоянието на майката и плода. Също така знаем, че храненето, стресът и други фактори на околната среда могат да модифицират епигенома. Има отлични статии за преглед, публикувани наскоро, които подчертават връзката между епигенетичните промени и метаболитните заболявания като инсулинова резистентност, затлъстяване, хипертония и сърдечно-съдови заболявания. Двойни проучвания разкриват, че наследствеността на теглото при раждане може да варира от 30 до 70%. [22] Надлъжното проучване на Avon за родители и деца (ASPLAC), което е надлъжно проучване на бременността и детството, съобщава за митохондриален вариант, свързан с по-тънки бебета при раждането. Интересното е, че едни и същи бебета са имали повишено постнатално наддаване на тегло. [23]
Двете ключови концепции, които трябва да бъдат взети предвид при обсъждането на генетичните фактори, влияещи върху теглото при раждане и метаболитните заболявания след раждането, са епигенетиката и геномното импринтиране. Епигенетиката се определя като изследване на наследствени промени, различни от тези в ДНК последователността, които обхващат две основни модификации на ДНК или хроматин, а именно метилиране на ДНК, ковалентна модификация на цитозин и пост-транслационна модификация на хистони, включително метилиране, ацетилиране, фосфорилиране и сумоилация. [24] Епигенетичните модификации могат да повлияят на селективната експресия на алелите на майката и бащата. Този процес на заглушаване на един родителски алел се нарича геномно импринтиране.
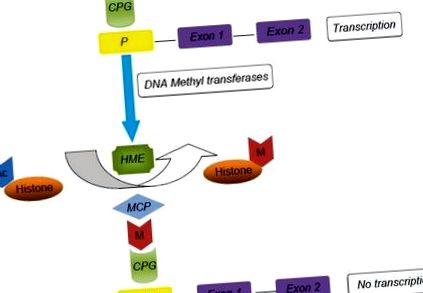
ДНК метилирането играе важна роля в дългосрочното заглушаване на генните експресии. От друга страна, модификациите на хистона могат да бъдат краткотрайни и гъвкави. [25] Изследванията на гаметогенезата разкриват диференциално метилиране, което е преди раждането в мъжката зародишна линия и след раждането в женската зародишна линия. [26,27] В скорошна статия Gluckman направи преглед на генетичния механизъм на епигенетичната модификация на генната експресия. [ 25] В активен ген CpG динуклеотидите в зоната на генния промотор са неметилирани, което дава на транскрипционните фактори и РНК полимераза свободен ход и ще настъпи транскрипция на екзон [Фигура 1]. В присъствието на ДНК метилтрансферази (DNMTs) се получава метилиране на CpGs, което от своя страна води до свързването на метил CpG свързващ протеин 2. Тези събития извеждат нататък хистономодифициращите ензими (HMEs), а именно хистон деацетилазата и хистон метилтрансферазата който деацетилира хистоните и съответно метилира остатъците от лизин. Крайният резултат е конформационна промяна в хроматиновата верига, която предотвратява действието на транскрипционни фактори и РНК полимерази. Настъпва неактивно състояние, което води до заглушаване на ДНК.
Епигенетични модификации и генна експресия. TF: Транскрипционни фактори, P: Промотор, HME: Хистон модифициращи ензими, M: Метилова група, Ac: Ацетилова група, MCP: Метил CPG свързващ протеин
Има много животински модели, илюстриращи как специфични екологични ситуации предизвикват епигенетични модификации, като жизнеспособна жълта (vy) мишка. Хиперметилирането на генния промотор намалява експресията на агути, което чрез своите ефекти върху хипоталамуса поражда мишки с нормално тегло и кафяв цвят на козината. Свързаният с Agouti протеин е орексегенен пептид, който играе важна роля в хипоталамусния контрол на поведението при хранене. Хипометилирането води до повишена експресия на гена на агути и мишката развива затлъстяване и жълто оцветено покритие. Хипометилирането се случва при майчин дефицит на метилни донори и кофактори като фолат, докато хиперметилирането може да бъде индуцирано от майчин прием на соев изофлавон генистеин. [28,29]
Проучванията при хора, макар и малко, също са забележителни в това, че показват ефекта от хранителната модификация на епигенома. В проучване на Yajnik et al., Се наблюдава повишена инсулинова резистентност при деца, чиито майки са с дефицит на витамин В12 с достатъчна фолиева киселина. Всъщност нивата на фолиева киселина по време на бременност са били положително свързани с детското затлъстяване и инсулиновата резистентност, докато нивата на витамин В12 отрицателно корелират със същите. [50] Тези открития демонстрират силата на метиловите донори и техните кофактори да променят епигенома и в крайна сметка да повлияят на фенотипа на възрастните. При пациенти с хиперхомоцистеинемия се натрупва S-аденозилхомоцистеин, инхибитор на ДНК метилтрансферази. Това води до по-ниски нива на метилиране на ДНК и преминаване от моноалелна към биалелна експресия за някои отпечатани гени (включително H19). Добавянето на фолиева киселина нормализира нивата на метилиране на ДНК и възстановява моноалелната експресия на гена H19. [51] Има доказателства, които ни казват, че ефектът от хранителните модификации може да продължи през няколко поколения въпреки хранителните корективни мерки. [52]
СОЦИАЛНО-ИКОНОМИЧЕСКИ Ф ИКТОРИ В ИНДИЯ P ОТДЪРЖАНЕ НА РАЗВИТИЕТО НА РАЗВИТИЕТО НА ДЪРНОВОДНА БОЛЕСТ
Индия бързо преминава през демографски, икономически и здравен преход, докато напредва през 21 век. Наблюдава се намаляване на суровата смъртност, раждаемостта, детската смъртност и нараства населението във възрастовата група между 15 и 59 години. Наблюдава се и постоянно нарастване на доходите на глава от населението, като намалява бедността. Миграцията в селските градове е довела до постоянен растеж на градското население и създаване на мегаполиси. Майчините и перинаталните проблеми в Индия са все още високи, а незаразните заболявания като диабет и сърдечно-съдови заболявания бързо нарастват. [53]
През годините се наблюдава относително намаляване на цената на зърнените култури. Консумацията на зърнени култури обаче не се е увеличила, освен в групата с най-ниски доходи. Селското население консумира повече зърнени култури, по-малко варива и по-малко масло, мазнини и захари, в сравнение с градското население. С появата на оператори за бързо хранене с храна с висока енергийна плътност и заседнал начин на живот сред градското население, затлъстяването се увеличава.
Османи и Сен са обсъдили скритите наказания за неравенството между половете върху феталния произход на заболяването при възрастни в отличен преглед. [54] В развиващите се страни и особено в Индия, неравенството между половете влияе върху раждаемостта, смъртността и съотношението на мъжете при жените, което е засилено срещу женския пол. Не е тайна, че лошото здраве на майката влияе неблагоприятно върху здравето на плода. Светът преминава през епидемиологичен преход, при който смъртността и заболеваемостта от инфекциозни заболявания намаляват, докато смъртността и заболеваемостта поради неинфекциозни заболявания бавно се увеличават. В Индия има парадокс и населението страда от висока честота на инфекциозни и незаразни болести.
Статистическите данни показват, че макар момичетата и момчетата да имат подобно хранене при раждането си, докато растат, неравенството се прокрадва, като момичетата изостават от момчетата. Когато тези момичета достигнат репродуктивната възрастова група, те страдат от недохранване и анемия. Многостранността и относително младата възраст по време на брака също допринасят за ниското тегло при раждане на децата, родени от тези майки. Не е изненадващо, че децата, родени от тези жени, имат ниско тегло при раждане. Ако недохранването продължава през детството, това излага пациента на висок риск от инфекциозни заболявания. Икономическият и социален преход, съчетан с относително хранително благосъстояние през детството, излага тези пациенти на риск от затлъстяване, ИБС и инсулинова резистентност, като възрастни.
ПРИЛОЖАВАМ НИТРАУТЕРИННАТА СТРАНИЦА И РЕГУЛИРАНЕТО НА ГОРОДА
В изследването за хранене на майките в Пуна [67] бе установено, че индийските бебета са по-леки, по-ниски и по-слаби в сравнение с британските бебета. Налице е обаче относително запазване на подлопаточната мазнина и оскъдица на мастна тъкан. В друго проучване от същата група е установено, че концентрациите на лептин в шнура при британските и индийските бебета са сходни, въпреки факта, че индийските бебета са по-слаби и по-леки. [68] Тези открития предполагат по-високо затлъстяване при индийските бебета, което проправя път за концепцията за тънкото дебело индийско бебе. Yajnik и група също са изследвали размера на тялото, глюкозния толеранс, инсулиновата резистентност и сърдечно-съдовите рискови фактори при деца. На 4-годишна възраст нивата на глюкоза, инсулин и IGF-1 са в обратна връзка с теглото при раждане, след като се вземе предвид ефектът от настоящото тегло. [69,70] Те също така установяват, че скоростта на растеж на децата от 4 до 8 години е по-силен предиктор за инсулинова резистентност и сърдечно-съдов риск от измерванията на 8 години. [71] Тези концепции стават важни за децата, преминаващи през миграция от селски към градски, при осиновяване, и при тези, които стъпват на икономическата стълба и благосъстоянието, което в крайна сметка увеличава хранителната наличност. [72]
Въпреки че повечето от доказателствата посочват инсулиновата резистентност като основна патология зад диабета при деца с IUGR, някои доказателства сочат и към намалена секреция на инсулин. Проучванията показват смесени резултати, като някои показват връзка между ниското тегло при раждане и дефектната секреция на инсулин, докато други не показват подобна връзка. [71,73] По-ранно проучване съобщава, че броят на панкреатичните β клетки е намален при бебета с IUGR. [74 ] В интересен експеримент, секрецията на инсулин и инсулиновата чувствителност на млади мъже, които са били малки за гестационната възраст, се сравнява с контролите, като се грижи да се премахнат объркващите фактори. Въпреки че инсулиновата чувствителност е нормална, секрецията на инсулин намалява с 30%, когато се контролира инсулиновата чувствителност. Следователно е възможно също да има инсулинов секреторен дефект, съставен от инсулинова резистентност, който влиза в действие, когато те натрупват телесни мазнини. [75]
Адаптационният отговор на плода към хранително предизвикателна среда е запазването на неговата жизненоважна органна функция, а именно мозъка, за сметка на други органи в тялото. [76] Механизмите, чрез които плодът постига това, включват отклоняване на кръвта и храненето към мозъка, заедно с резистентността към инсулин и хормон на растежа в периферията. Гладуването или хранителният дефицит са свързани с намалена базална скорост на метаболизма (BMR). Ако енергията се съхранява, когато BMR е ниска, има относително предпочитание към съхранението на мазнини. Инсулиновата резистентност, свързана с намалена чиста мускулна маса заедно с хиперинсулинемия, насочва излишната глюкоза към съхранение на мазнини в мастната тъкан. [77–79] Въпреки че мазнините могат да действат като енергиен резервоар за жизненоважни органи, в хранително богата среда с ограничени енергийни разходи, настъпва отлагане на мазнини. Това отлагане на мазнини насърчава инсулинова резистентност, възпаление и накрая диабет и коронарна съдова болест. [72] Кохортата от SGA от Haguenau и подходящи за гестационна възраст (AGA) субекти разглеждат компонентите на метаболитния синдром на 22-годишна възраст. Метаболитният синдром е шест пъти по-често срещан при лица с SGA в сравнение с лица с AGA. [80]
ПРИЛОЖЕНИЕ НА Н ОРМОНАЛНИ АДАПТАЦИИ
Последните няколко десетилетия показаха висока активност в декодирането на молекулярни и клетъчни механизми, залегнали в основата на DOAD. [81] Концепцията за хормонално програмиране посочва, че неблагоприятната вътрематочна среда води до метаболитни и ендокринни адаптации, програмирани към енергоспестяване. Тези адаптации се оказват контрапродуктивни в зряла възраст, тъй като тялото е трудно да се адаптира към хранително обогатена среда и излишните хранителни вещества се отлагат като мастна тъкан. Аномалии в оста GH-IGF вече са описани в по-ранна част от статията.
Последните изследвания разкриха вълнуващо взаимодействие на адипоцитокини и последващо развитие на заболяване при възрастни в IUGR. Повечето проучвания показват ниски нива на лептин при новородени с IUGR. [81,96] Впоследствие, когато прогресират до детството и зрелостта, нивата на лептин са по-високи в сравнение с нормалната кохорта. Тази лептинова резистентност може да бъде адаптивна реакция, която може да служи като стимул за прием на храна и да насърчи догонващия растеж. [97] Проучванията, изследващи нивата на адипонектин, не успяват да покажат значителни разлики между новородените IUGR и нормалната кохорта, въпреки че съществуват противоречиви съобщения. [98-100] Въпреки това, SGA кърмачетата показват преминаване към по-висока молекулна форма на адипонектин, която е по-свързана с инсулиновата чувствителност. Идеята зад тази промяна е подобряване на чувствителността към инсулин и насърчаване на новородения наваксващ растеж. [101] Грелинът може да стимулира апетита и да стимулира секрецията на растежен хормон. Нивата на грелин са повишени в IUGR, което отново може да помогне за растеж след раждането. [102,103] Други адипоцитокини под активно разследване за ролята им в IUGR и последващото затлъстяване при възрастни и инсулинова резистентност включват тумор некрозис фактор-алфа (TNF-α ), интерлевкин-6 (IL-6), резистин, апелин и висфатин. [81]
М ВЪЗМОЖНО ОТ БЕСТИТЕ И D ЯБЕТА
Настоящите доказателства сочат към факта, че диабетът при майката предразполага към затлъстяване и диабет при плода при възрастни, дори след като други фактори, влияещи са коригирани. Доказателства за влиянието на вътрематочните метаболитни нарушения вследствие на майчиния диабет идват от проучването върху индианците от Пима. Установено е, че децата, родени от майки, които са били диабетици по време на бременността, са по-затлъстели от техните братя и сестри, родени преди началото на диабета. [104] Също така се забелязва, че диабетът е по-често при деца, родени от майки, които са имали диабет по време на бременността, в сравнение с бебета, родени от майки, които не са имали диабет по време на бременността, въпреки че впоследствие са развили диабет. [105] Бебетата с високо тегло при раждане също са склонни да развият затлъстяване и инсулинова резистентност по-късно в живота. [106] Изследване на Yajnik et al. показа, че по-високото тегло при раждане при деца е свързано с затлъстяване при родителите и метаболитен синдром при майката 8 години след раждането на детето. [107]
Дори затлъстелите жени с нормален глюкозен толеранс показват, че раждат бебета, които са имали повишен процент телесни мазнини. [108] И така, как се случва това? Метаболитните аномалии, които са налице при затлъстелите и диабетичните майки, се прехвърлят върху плода по време на вътрематочния период, създавайки риск от последващо затлъстяване. [109] Предлагат се множество пътища, включително регулирани плацентарни транспортери и променена фетална експресия на гени. [110] Друг интересен механизъм вероятно е ендотелната дисфункция с ранно начало. Проучванията показват, че нивата на ендотелните прогениторни клетки са намалени при новородени, родени от майки със захарен диабет тип 1 [111]. Ендотелните прогениторни клетки играят важна роля за възстановяването на съдовете и неоваскуларното образуване, а ендотелната дисфункция играе ключова роля в развитието на сърдечно-съдови заболявания. [112,113] Съществуващата литература ни дава известна представа за функцията на островните клетки в среда на хиперхолестеролемия. Доказано е, че хиперхолестеролемията индуцира апоптоза на островни клетки и понижаване на регулацията на глюкокиназата, което води до намалена секреция на инсулин. [114,115] Необходими са допълнителни проучвания, за да се подчертаят ефектите от хиперхолестеролемията и богата на хранителни вещества среда върху феталната секреция на инсулин.
C ЗАКЛЮЧЕНИЕ
Тревожното нарастване на диабета и други заразни болести наложи фокус да се премести от лечението на незаразните заболявания към тяхната профилактика. Понастоящем има достатъчно доказателства, за да се докаже вътрематочен произход на заразни болести. Тайните зад тези вътреутробни корени се решават чрез сегашното разбиране за епигенетични модификации и хормонални адаптации. Бъдещите изследвания върху феталния произход на болестта при възрастни трябва да бъдат насочени към разширяване на настоящите ни познания за молекулярните механизми. В крайна сметка хоризонтът може да отвори превантивни хранителни модификации с геномни и хормонални цели за профилактика на заболяванията.
Бележки под линия
Източник на подкрепа: Нил
Конфликт на интереси: Никой не е деклариран.
- Eukanuba Ветеринарна дерматоза FP Храна за възрастни кучета от; Waitrose Pet
- Вродена контрактурална арахнодактилия (синдром на Beals) Orphanet Journal of Redki болести Пълен текст
- Хранителни рецепти могат да лекуват хронични заболявания
- Храни за малки деца със задръствания Как да възрастни
- Диетичната хуморна храна замени секса Диетична кърпа за възрастни Вземете Etsy