Резюме
Заден план
Целта ни беше да определим степента на повишаване на теглото след лечение, което се наблюдава при педиатрични пациенти през първата година след терапия с радиоактивен йод (RAI) за болестта на Грейвс (GD) и връзката му с клиничните характеристики.
Методи
Извършен е ретроспективен преглед на диаграмата на пациенти, получаващи RAI терапия за GD между 1998–2015. Промяната в ИТМ SDS (∆BMI SDS) от изходното ниво до една година след лечението беше определена. Също така изследвахме дали отделни клинични и/или биохимични фактори са свързани с траекторията на теглото при тези пациенти.
Резултати
Сто петдесет и седем пациенти на възраст 12,7 ± 3 години (80% момичета) бяха включени в анализа. Средният ∆BMI SDS е 0,70 ± 0,71 (стр
Заден план
Болестта на Грейвс (GD), характеризираща се с автоимунна свръхстимулация на щитовидната жлеза, е най-честата причина за хипертиреоидизъм при деца и юноши [1,2,3,4]. Общата честота в педиатричната популация е приблизително 1 на 10 000 [5] с най-високо разпространение при юношите [2]. Въпреки че хиперметаболитното състояние при GD обикновено води до загуба на тегло, може да се наблюдава стабилно тегло или дори наддаване на тегло поради увеличения прием на калории [5].
Терапевтичните начини за лечение на GD включват хирургия, аблация на радиоактивен йод (RAI) и антитиреоидни лекарства (ATD). Хирургията и RAI се считат за окончателна терапия и водят до постоянен хипотиреоидизъм. Пациентите, получаващи окончателна терапия, често стават хипотиреоиди за определен период от време, преди да се постигне подходящо заместване на левотироксин и биохимичен еутиреоидизъм. Повишаване на теглото след лечение на GD се съобщава както при деца, така и при възрастни. Предложените обяснения включват продължаване на увеличената консумация на калории с разрешаване на предишното хиперметаболитно състояние [5], връщане към или преувеличение на преморбидното тегло [6] или резултат от хипотиреоидизъм след лечение [7]. Предишни проучвания, съобщаващи за промяна в теглото след лечение на GD при деца, са се фокусирали основно върху пациенти, лекувани с ATD като терапия от първа линия. За разлика от това, промяната в ИТМ след лечение с RAI не е систематично изследвана. Не е известно дали самият начин на лечение влияе върху степента на наддаване на тегло или има клинични или биохимични фактори, които могат да модулират степента на наддаване при тези пациенти [7,8,9].
По този начин целта на нашето проучване беше да се изследва степента на наддаване на тегло през първата година след RAI терапия за GD. Също така се опитахме да проучим дали индивидуалните характеристики са свързани с разликите в наддаването на тегло сред нашите пациенти.
Методи
След етичен преглед и одобрение на Протокол № 1412088318 от Институционалния съвет за преглед на университета в Индиана, беше извършен ретроспективен преглед на диаграмата на педиатрични пациенти, получаващи RAI аблация за GD в болница за деца Riley между 1998 и 2015 г. Всички пациенти с документирана височина и тегло в рамките на четири месеца преди лечението с RAI и последващо посещение с документирана височина и тегло между 6 и 18 месеца след датата на RAI. Независимо дали пациентите са били лекувани за GD преди оценка в нашата институция, всички пациенти са били хипертиреоидни по време на RAI. Ако е необходима втора доза RAI, дозата, водеща до успешна аблация (т.е. втората доза), се използва като събитие от интерес за определяне на височината и теглото преди и след лечението.
Търсени са медицински досиета за променливи от интерес, които включват възраст, пол, пубертетен статус, история на загуба на тегло, DS (синдром на Даун), употреба на лекарства за ADHD, употреба на ATD за ≥ един месец преди RAI, начална дата на заместване на левотироксин, и датата на документиран еутиреоидизъм. Теглото и височината бяха събрани на изходно ниво (последно назначение преди RAI) и при едногодишен последващ прием. ИТМ се изчислява по формулата. Пубертетният статус е класифициран като предпубертетен (Tanner I) или пубертетен (Tanner II-V). Еутиреоидизмът се счита за TSH и свободен T4 или общ T4 в рамките на референтния диапазон на изпълняващата лаборатория, или (в малка част от случаите), документирано тълкуване на лабораторните тестове като „нормално“ от първичния ендокринолог.
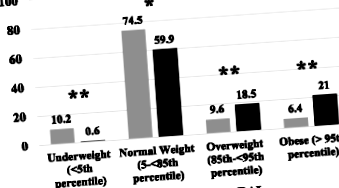
Всички ИТМ са категоризирани според стандартите на Центровете за контрол на заболяванията (CDC) като поднормено тегло (th процентил), нормално тегло (5- th percentile), наднормено тегло (85th percentile) или затлъстяване (≥95 th percentile) [10]. Времето до еутиреоидизъм (TTE) беше изчислено чрез определяне на времето в седмици между датата на започване на заместването на левотироксин и датата на документирания еутиреоидизъм.
Статистика
Анализите бяха извършени с помощта на статистически софтуер SPSS (версия 24; IBM Corp.). Всички интересни променливи бяха оценени за нормалност, за да се определи целесъобразността на статистическите методи и беше установено, че са нормално разпределени. Описателната статистика беше използвана за докладване на антропометрични данни и интервали от време. Тестовете с хи-квадрат и точните тестове на Fisher бяха използвани за анализ на разликите в разпределението на категориите тегло преди и след RAI. Използвани са сдвоени t-тестове за оценка на разликите в ИТМ преди и след лечението. Бяха използвани несдвоени t-тестове за анализ на ефекта от клиничните рискови фактори върху наддаването на тегло. Линейната регресия беше използвана, за да се опише силата на връзката между промяната (∆) в ИТМ SDS във времето и допринасящите фактори. Нивото на значимост е α = 0,05, като всички р-стойности по-ниски от 0,05 се считат за статистически значими. Резултатите са изразени като средна стойност ± SD в текста, като медианите и диапазоните също са предоставени в таблица 1.
Резултати
От 247 пациенти, получаващи RAI за GD, 157 (79,6% жени) са имали пълни данни и са били включени в анализа. Средната изходна възраст е 12,7 ± 3,0 години, а средната изходна стойност на ИТМ SDS е 0,003 ± 1,18 kg/m 2. Десет пациенти (6,4%) са имали DS (синдром на Даун), а 33 (21,0%) са получавали ATD преди аблация на RAI. От 135 пациенти с документиран пубертетен статус, 88 (65,2%) са били ≥ Tanner етап II при изходната оценка. Данните за ИТМ след лечението са получени на 50,65 ± 11,32 седмици след RAI.
Средният ∆BMI SDS от изходното ниво до една година е 0,70 ± 0,71 (p Фиг. 1
Извършен е субанализ на 81 пациенти (85,2% жени) с доказателства за добро съответствие, при които е налице точната ТТЕ. В рамките на тази група TTE е 24,16 ± 13,28 седмици и ∆BMI SDS за една година не се различава от групата като цяло. За разлика от наблюдаваното за цялата кохорта, историята на загуба на тегло не е оказала влияние върху ∆BMI SDS до 1 година, (0.77 ± 0.62 срещу 0.55 ± 0.56, p = 0,12), докато е установено, че пациентите в предпубертетно време имат по-голям ∆BMI SDS от пациентите в пубертета на 1 година (0,90 ± 0,11 срещу 0,57 ± 0,58, p = 0,037). При мъжете по-дългият ТТЕ е корелиран с по-голямо увеличение на BMI z-score (R = 0.63, p = 0,029) (фиг. 2), докато подобна, макар и по-слаба асоциация се наблюдава при жените (R = 0,59, p ≤ 0,001).
Връзка на ∆BMI SDS с времето към еутиреоидизма при момчетата
Дискусия
Увеличаването на теглото след лечение на GD е добре разпознато при възрастни, но досега са публикувани само две предишни проучвания при педиатрични пациенти [5, 11]. Тези проучвания включват пациенти, които са били почти изключително лекувани с ATD като терапия от първа линия и не са изследвали внимателно толкова много потенциални модифициращи фактори. Наблюдавахме ∆BMI SDS от 0,70 ± 0,71 през първата година в нашата популация, получаваща RAI терапия като окончателно лечение за GD. Едно предишно проучване проследява деца до 3 години и наблюдава подобно увеличение на BMI z-score след лечение от -0,02 ± 1,05 до 0,79 ± 0,81 с последващо стабилизиране на теглото, като най-голямото наддаване се наблюдава през първите 6 месеца от лечението [ 5]. Второ проучване, сравняващо промените в теглото след лечение както на хипотиреоидизъм, така и на хипертиреоидизъм, също съобщава за увеличаване на теглото след лечение на GD в началото на проследяването, въпреки че точната времева рамка не е посочена [11].
Не е изненадващо, че историята на загуба на тегло преди RAI е свързана с по-голямо наддаване на тегло при проследяване в нашата популация, въпреки че тази връзка не присъства в поданализа. Въпреки това, пациентите преди пубертета в нашия суб-анализ са имали по-голям greaterBMI SDS. Това е в съответствие с друго проучване, което наблюдава по-голямо увеличение на ИТМ след лечение на GD при деца под 11 години в сравнение с по-големите деца [5]. Не е известно дали тази връзка е резултат от възрастта или от метаболитните промени, които настъпват по време на пубертета. Не са открити други фактори, които ясно да определят групите с по-висок риск за напълняване в нашето население. Всички пациенти, получаващи RAI за GD, трябва да се считат за изложени на висок риск от наддаване на тегло и съответно да се консултират.
Въпреки че нашето проучване беше фокусирано върху ефектите от терапията с RAI, 21% от пациентите преди това са получавали ATD и не са имали разлика в SDSBMI SDS за една година в сравнение с тези, които не са. Повечето пациенти, лекувани с ATD, не са били наблюдавани в нашата институция при първоначалното им представяне с GD и следователно техните ИТМ преди лечението не са били налични. Предишни изследвания обаче предполагат, че използването на последователни начини на лечение при възрастни може да доведе до продължително наддаване на тегло в сравнение с окончателното лечение като подход от първа линия [8]. Този въпрос би бил интересен за изследване и при педиатрични пациенти. Ако е потвърдено, това може да е допълнителна причина да се застъпва за по-ранно окончателно лечение, вместо да се провежда медицинска терапия, която рядко води до трайна ремисия при деца и юноши и носи потенциал за редки, но сериозни странични ефекти [12].
Докато TTE беше отрицателно корелиран с ∆BMI SDS при нашата субанализа, слабостта на тази връзка предполага, че трябва да се имат предвид и други фактори. Въпреки че някои проучвания при възрастни показват разлики в резултатите от ИТМ по начин на лечение [8, 9], това не е демонстрирано последователно и не е известно дали тези очаквания могат да се разширят и върху децата. Открихме подобни резултати при нашето население в сравнение с доклади от други центрове [5].
Доколкото ни е известно, нашето проучване представлява най-голямата кохорта от педиатрични пациенти, при които се изследва наддаването на тегло след лечение на GD, и единственото, при което всички пациенти са били лекувани с RAI. Ограниченията включват неговия ретроспективен характер, както и факта, че данните, документиращи точната ТТЕ, са налични само при 81 от нашите пациенти. Допълнителна слабост е, че не разполагахме с информация относно ИТМ на нашите пациенти преди развитието на GD. Въпреки това, близо 40% от нашите пациенти са били или с наднормено тегло, или със затлъстяване на една година, процент над националните данни за ИТМ SDS при младежи на възраст 2–19 години [13].
Заключения
В заключение, наблюдаваме поразително и почти универсално увеличение на ИТМ SDS една година след лечение с RAI за GD, което води до удвояване на броя на наднорменото тегло и утрояване на броя на затлъстелите пациенти, излагайки ги на по-висок риск от неблагоприятни последици за здравето над време. Бъдещите проучвания трябва да се фокусират върху целенасочени интервенции, насочени към намаляване на скоростта на наддаване на тегло при деца и юноши, подложени на лечение за GD.
- Опитът от диети с ниско съдържание на йод при лечение на диференциран рак на щитовидната жлеза с радиоактивен
- Хронична гнойна белодробна болест при възрастни - Metersky - Journal of Thoracic Disease
- Причинява ли физическото бездействие неалкохолна мастна чернодробна болест Journal of Applied Physiology
- Конкуренция във фармацевтичната индустрия Случаят с PAH Drugs International Journal of the
- Динамична промяна на фокусното пестене на мазнини при безалкохолна мастна чернодробна болест след лечение с