Мари-Софи Нгуен-Ту
1 LBTI, UMR CNRS 5305, 69367 Lyon Cedex 07, Франция
2 University of Lyon 1, 69367 Lyon Cedex 07, Франция
Пиер Нивоа
1 LBTI, UMR CNRS 5305, 69367 Lyon Cedex 07, Франция
2 University of Lyon 1, 69367 Lyon Cedex 07, Франция
Валерия Ореа
1 LBTI, UMR CNRS 5305, 69367 Lyon Cedex 07, Франция
2 University of Lyon 1, 69367 Lyon Cedex 07, Франция
Sandrine Lemoine
2 University of Lyon 1, 69367 Lyon Cedex 07, Франция
Сесил Аквавива
1 LBTI, UMR CNRS 5305, 69367 Lyon Cedex 07, Франция
3 Center de Biologie et Pathologie Est, Университетска болница, Hospices Civils de Lyon, 69677 Bron, Франция
Aurélie Pagnon-Minot
4 Novotec, ZAC du Chêne Europarc, 11 rue Edison, 69500 Bron, Франция
Bérengère Fromy
1 LBTI, UMR CNRS 5305, 69367 Lyon Cedex 07, Франция
2 University of Lyon 1, 69367 Lyon Cedex 07, Франция
Jaswinder K. Sethi
5 Медицински факултет, Университет в Саутхемптън, Институт за науки за развитие, сграда на Обща болница в Саутхемптън, Саутхемптън, SO16 6YD Великобритания
6 Национален институт за здравни изследвания Southampton Biomedical Research Center, University Hospital Southampton NHS Foundation Trust, Southampton General Hospital, Southampton, SO16 6YD UK
7 Институт за науки за живота, сграда на науките за живота 85, Университет в Саутхемптън, Хайфийлд, Саутхемптън, SO17 1BJ Великобритания
Доминик Сигаудо-Русел
1 LBTI, UMR CNRS 5305, 69367 Lyon Cedex 07, Франция
2 University of Lyon 1, 69367 Lyon Cedex 07, Франция
Свързани данни
Резюме
Предистория/цели
Повишеното разпространение на затлъстяването доведе до големи крачки в нашето разбиране на специфични мастни депа и тяхното участие в сърдечно-метаболитното здраве. Въпреки това, въздействието на затлъстяването върху дермалната бяла мастна тъкан (dWAT) и дермалната микросъдова функционалност остава неясно. Това проучване има за цел да изследва временните промени, които се появяват в dWAT и дермалната микросъдова функционалност по време на развитието на диета, предизвикано от затлъстяване и диабет тип 2 при мишки.
Методи
Метаболитно фенотипизиране на миши модел на хиперкалорична диета (HCD) -индуцирано затлъстяване и диабет тип 2 се извършва в три времеви точки, които отразяват три различни етапа на развитие на заболяването; 2 седмици с HCD с наднормено тегло - метаболитно здрави, 4 седмици с HCD - със затлъстяване - предидиабет и 12 седмици с HCD - със затлъстяване от мишки с диабет тип 2. Разширяването на dWAT се характеризира хистологично и се оценяват промените в дермалната микроваскуларна реактивност в отговор на налягането и вазодилататорите SNP и Ach.
Резултати
HCD доведе до прогресивно разширяване на dWAT и повишена експресия на провъзпалителни маркери (IL1β и COX-2). Нарушенията на индуцираното от налягане (PIV) и индуцираното от Ach (ендотел-зависимо) вазодилатация са настъпили рано при здрави мишки с метаболитно наднормено тегло. Остатъчните вазодилататорни отговори са независими от NOS, но чувствителни към инхибиране на COX. Тези промени са свързани с намаляване на бионаличността на NO и адипонектин и са спасени чрез екзогенен адипонектин или хиперинсулинемия. Затлъстелите преддиабетни мишки продължават да проявяват нарушена Ach-зависима вазодилатация, но PIV изглежда нормализиран. Това нормализиране съвпадна с повишените ендогенни нива на адипонектин и инсулин и беше чувствително към инхибиране на NOS, COX и PI3K. При мишки с диабет тип 2 със затлъстяване, както стимулираните от Ach, така и индуцираните от налягането вазодилататорни отговори се увеличават чрез засилен COX-2-зависим простагландинов отговор.
Заключения
Ние демонстрираме, че развитието на затлъстяване, метаболитна дисфункция и диабет тип 2, при мишки, хранени с HCD, е придружено от повишено дермално затлъстяване и свързано метавъзпаление в dWAT. Важно е, че тези временни промени са свързани и със специфичната за стадия на заболяването дермална микросъдова реактивност, която може да отразява адаптивни механизми, задвижвани от метавъзпаление.
Въведение
В това проучване ние изследваме временните промени в дермалното затлъстяване, дермалната микросъдова функционалност и ендотелната функция по време на развитието на затлъстяване и диабет тип 2. Предполагаме, че ремоделирането на дермалния мастен слой и развитието на диабет тип 2 са свързани с промени в дермалната микроваскуларна реактивност на налягането. Нашите открития показват, че първоначално, в началото на повишеното затлъстяване, промените в невроваскуларната и ендотелната функция са свързани с променено производство на адипокин. Въпреки това, тъй като затлъстяването прогресира до състояния преди диабет и диабет, възникват допълнителни адаптации за нормализиране и след това засилване на дермалната съдова реактивност към натиск. В механично отношение тези адаптивни промени включват промяна в ключовите вазодилататорни сигнални пътища от NO-зависими към провъзпалителни програми, управлявани от COX-2/PG.
Изследователски дизайн и методи
Животни
Тестове за глюкоза и инсулинов толеранс
След 2, 4 и 12 седмици диета бяха проведени тестове за толерантност към глюкоза и инсулин на 5 h гладни мишки след интраперитонеална (ip) инжекция или на глюкоза (1 g kg -1 телесно тегло) за тест за толерантност към глюкоза или инсулин ( 0,75 U kg -1 телесно тегло; Lilly, Suresnes, Франция) за тест за толерантност към инсулин. Глюкозата в кръвта се проследява в продължение на 2 часа с глюкомер (AccuCheck® Active; Roche, Lyon, Франция). Мишките с изходни нива на кръвната захар на гладно> 250 mg/dL се считат за диабетни, докато нивата между 200 и 250 mg/dL се определят като преддиабетни и -1; Nesdonal, Merial, Lyon, France) и мишки, в легнало положение, бяха почивани в инкубатор с контролирана дермална температура и систолно артериално кръвно налягане, както беше описано по-горе [28]. Всяка кожна лезия на животното в деня на експеримента доведе до изключване.
Ендотел-зависима и независима вазодилатация
Лазерният доплер-поток (LDF) в отговор на йонофореза на ацетилхолин (Ach) и натриев нитропрусид (SNP) (Saint Quentin Fallavier, Франция) беше измерен, за да се оцени микросъдовата реактивност на кожата на обезкосмения гръб на животните, както е описано по-рано [19, 28].
Индуцирано от натиск вазодилатация
Локалният LDF отговор, измерен от налягането, беше измерен, както беше описано по-рано [19, 28]. Сондата за налягане се поставя върху обезкосмената кожа на горната част на главата и външното налягане се увеличава постепенно при 2,2 Pa s -1 чрез лазерна доплерова сонда, използвайки спринцовка.
Проучвания за фармакологично инхибиране
Стимулираната вазодилатация се оценява след предварителна обработка с DMSO (контрол), вортманин за инхибиране на фосфатидилинозитол 3-киназа (PI3K) или N ω-нитро-L-аргинин (LNNA), инхибитор на NO-синтаза (NOS). Измервано е систоличното артериално кръвно налягане, за да се провери повишаването на кръвното налягане, причинено от LNNA, специфичен инхибитор на NOS (20 mg kg -1; ip) [28]. За инжектиране на вортманин (в 4% DMSO; 16 µg kg -1; ip) протоколът се провежда, както е описано по-горе, след период на почивка от 15 минути [29]. Индометацин (5 mg kg -1; ip), се използва като неспецифичен инхибитор на циклооксигенази (COX) [30, 31], докато специфично инхибиране на индуцируем COX-2 (Cayman Chemicals, MI, USA) е постигнато със SC- 58125 (10 mg kg -1; iv) [32]. Ролята на инсулина и адипонектина в PIV се оценява или чрез еднократна ip инжекция на инсулин (0,05 UI 25 -1 g телесно тегло на мишка; Lilly, Suresnes, Франция) или чрез еднократна интрадермична инжекция на адипонектин (50 µg.mL -1; Enzo LifeSciences, Farmingdale, NY). Оценката на PIV е проведена 15 минути след инжектиране на инсулин и веднага след инжектиране на адипонектин.
В края на съдовите експерименти животните бяха евтаназирани чрез предозиране с тиопентал.
Плазмена биохимия
Плазмата е получена чрез сърдечна пункция и е анализирана от Center de Biologie Est (Лион, Франция) за липиди (холестерол/триглицерид, Abbott Laboratories, Abbott Park, IL; свободна мастна киселина, Wako Chemicals, Осака, Япония), търговски колориметричен ELISA използвани са анализи за определяне на плазмен инсулин (Mercodia, Uppsala, Швеция) и адипокини (лептин/адипонектин, Millipore, St. Charles, MO) съгласно протокола на производителя.
Уестърн блотинг
Имуноблотинг с използване на анти-COX-2 (Cayman Chemicals, # 160126) се извършва върху кожа, събрана от всяка група. Ефективността на фармакологичните лекарства е потвърдена чрез имуноблотинг с използване на анти-фосфо-eNOS-Ser 1177, анти-фосфо-Akt-Ser 473 (технология за клетъчна сигнализация; Danvers, MA) върху третираната кожа, събрана при максимум PIV.
Имунохистохимия и морфометричен анализ
Статистически анализ
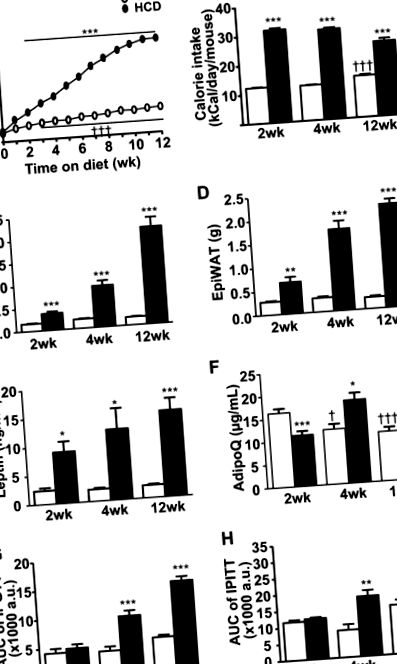
Ефект на HCD върху развитието на затлъстяване и метаболитен синдром. Мишките бяха хранени или с хиперкалорична диета (пълни кръгове и решетки), или със стандартна чау (отворени кръгове и решетки) за 2, 4 или 12 седмици. а Телесно тегло на мишки по време на 12-седмичната програма за хранене. б Калориен прием на контролни и HCD хранени мишки. ° С Тежести на подкожната бяла мастна тъкан (ScWAT). д Тежести на епидидимална бяла мастна тъкан (EpiWAT). д Циркулиращи нива на лептин. е Циркулиращи нива на адипонектин (AdipoQ). ж Площ под кривата (AUC) на нивата на глюкоза по време на тестове за толерантност към глюкоза (IP-GTT) и з Тестове за инсулинова толерантност (IP-ITT). Вижте също Допълнителна фиг. 1. Данните представляват средно ± SEM (n = 10 във всяка група или n = 50 във всяка група за телесно тегло) * p † p †† p ††† p (фиг. 1f) 1f) са по-ниски, но мишките остават евгликемични и не се наблюдават разлики в плазмените нива на инсулин (Таблица S1), глюкозния толеранс (Фиг. (Фиг. 1g 1g и Фиг. S1A) или инсулиновия толеранс (Фиг. (Фиг. 1h 1h и Фиг. Следователно, тази 2-HCD група представлява модел на „мишки с наднормено тегло, метаболитно здрави", макар и с намален адипонектин. След 4 седмици, 4-HCD мишки са били със затлъстяване и са имали нормализирани нива на адипонектин (Фиг. ) 1f) и са били много леко хиперинсулинемични и хипергликемични (Таблица S1). И толеранс към глюкоза- (Фиг. (Фиг. 1g 1g и Фиг. S1C) и инсулин- (Фиг. (Фиг. 1h и Фиг. S1D)) са били и с леко увреждане в сравнение с подходящи за възрастта контролни диети, хранени с мишки. Следователно, тази 4-HCD група представлява модел на „затлъстели преддиабетни мишки. и хиперлипидемия (Таблица S1) заедно с нарушен толеранс към глюкоза и инсулин. (Фиг. 1g, h и Фиг. S1E-F). Следователно тези мишки показаха установен стадий на заболяването, характерен за „затлъстяването и диабет тип 2“.
Забележително е, че контролната диета, хранена с постни мишки, също показва промени, зависими от времето в техните метаболитни профили, които стават значими след 12 седмици. Промените включват малко, но значително увеличение на телесното тегло (Фиг. 1а, Таблица S1) и прием на храна (Фиг. (Фиг. 1b), 1b), но не се превръщат в значително по-големи складове с WAT (Фиг. 1в, d) нито повишен плазмен лептин (фиг. (фиг. 1д). 1д). Най-старите слаби мишки остават толерантни както към глюкозата (фиг. (Фиг. 1g) 1g), така и към инсулина (фиг. (Фиг. 1h). 1h). Въпреки това плазмените нива на адипонектин прогресивно намаляват (фиг. (Фиг. 1е) 1е) и се наблюдава лека хипергликемия на гладно до 12 седмици (таблица S1).
Ремоделирането на dWAT придружава развитието на HCD-индуцирано затлъстяване
При мишки, хранени с HCD, мастният слой на кожата [33] вече беше разширен в най-ранната точка от времето (фиг. 2а, б). DWAT заема по-голяма площ с времето на HCD (фиг. 2а, b и фиг. S2A) и е придружен от прогресивно нарастване както на адипоцитната хиперплазия, така и на хипертрофия в сравнение с контролни диети, хранени с мишки (фиг. 2а 2а и фиг. S2B). Имунохистохимичното оцветяване за макрофаги (анти-F4/80) и провъзпалителни цитокини (анти-IL-1β) разкрива прогресивно увеличаване на инфилтрацията на макрофаги след 4 седмици (фиг. (Фиг. 2а). 2а). При 12-HCD мишки имаше забележимо натрупване на провъзпалителни (M1-подобни) макрофаги в „короноподобни" структури. При кожни биопсии, нивата на протеин на свързания с възпалението COX-2 също постепенно се увеличаваха с повишено дермално затлъстяване (Фиг. (Фиг. 2в 2в и Фиг. S2C). Въпреки това, няма промяна в структурата на дермалните съдове при HCD и контролни мишки (Фиг. (Фиг. 2а 2а).
Ефект на HCD върху дермално мастно ремоделиране и възпаление. а Представителни микрофотографии на имунохистохимични срезове от посочени групи след оцветяване с хематоксилин и еозин, F4/80 или анти-IL1-бета. (Мащабни ленти: 500 µm (малко магнитно) и 25 µm (голямо магнитно).) б Дебелината на дермалната мастна тъкан се определя по отношение на комбинираната дебелина на папиларната дерма и ретикуларната дерма. За всяка от пет мишки бяха изчислени 10 произволно избрани измервания от хистологични изображения и измерени с помощта на изображение J. Данните представляват средно ± SEM (n = 5 във всяка група) * p (Фиг. 3а). 3а). Този PIV отговор обаче изглежда нормализиран при 4-HCD мишки и е значително увеличен при 12-HCD мишки в сравнение с възрастово съвместими слаби контроли. За разлика от това, максималната стимулирана от SNP (независима от ендотел) вазодилатация остава сходна между HCD и контролните групи (Фиг. (Фиг. 3b) 3b) във всички групи, което предполага, че капацитетът за релаксация на кожните гладки мускули не се променя по време на развитието на затлъстяване и диабет тип 2. Въпреки това, стимулираната от Ach (зависима от ендотел) вазодилатация е нарушена в ранен стадий на заболяването, както при 2-HCD, така и при 4-HCD мишки (Фиг. (Фиг. 3в). 3в). Забележително е, че 12-HCD мишки показаха по-голям вазодилататорен отговор на Ach, който се дължи отчасти на намаляване на Ach-стимулираната вазодилатация при контролни слаби мишки (фиг. (Фиг. 3в) 3в), което може да разкрие темпорална ендотелна дисфункция, подобна до 2-HCD мишки. Въпреки това, нивата на холестерола остават в нормалните граници във всички групи, с изключение на объркващия ефект на хиперхолестеролемия, свързан със затлъстяването/диабет тип 2 върху микросъдовите промени.
Зависими от времето ефекти на HCD върху съдовата реактивност. Максималното процентно увеличение на доплерната флоуметрия на кожата (LDF) беше определено в отговор на а лек натиск, б йонофоретично доставяне на SNP и ° С Ач. Данните представляват средна стойност ± SEM (n = 10 във всяка група); * p † p 4a, b) или Ach- (Фиг. 4c, d) стимулира вазодилатацията при 2-HCD мишки. Това предполага, че NOS-зависимата вазодилатация се губи. Инхибиторът на PI3K, вортманин, няма ефект върху двата вазодилататорни теста и в двете диетични групи (фиг. 4а-г). Уестърн блотингът обаче за фосфоактивен-AKT и фосфоактивен-eNOS потвърди, че тези инхибитори са ефективни на молекулярно ниво (фиг. S4). Освен това, лечението с индометацин, инхибитор на COX-1/2, демонстрира, че остатъчната съдова функционалност при 2-HCD мишки е чувствителна към простагландин-зависими сигнали (Фиг. 4а-d).
Нормализирането на PIV при затлъстели преддиабетни мишки изисква адаптивни PI3K-зависими NO сигнали
Тъй като затлъстелите преддиабетни (4-HCD) мишки са имали повишен инсулин (Таблица S1) и нормализираните нива на адипонектин (фиг. (фиг. 1е), 1е), а отговорите на ПИВ станаха подобни на съвпадащи с възрастта слаби мишки (фиг. (фиг. 3а), 3а), ние изследвахме възможността, задвижвана от хиперинсулинемия инсулиновата сигнализация е участвала в адаптивния механизъм за нормализиране на PIV. За да изследваме изискването за функционален инсулинов рецептор/PI3K/AKT/NOS сигнален път, ние повторихме PIV и Ach-стимулирани тестове след прилагане на селективни инхибитори на пътя при 4-HCD мишки. Тук PIV е чувствителен към инхибиране на NOS от LNNA и към PI3K инхибитор, вортманин (Фиг. (Фиг. 5b). 5b). За разлика от това контролните мишки остават нечувствителни към вортманин (фиг. (Фиг. 5а). 5а). Това показва набирането на PI3K-зависим NOS път в PIV отговор на 4-HCD мишки, докато PI3K-независим NOS път остава функционален при контролни слаби мишки. Интересното е, че чувствителността към уртманин и NOS не се наблюдава при стимулирана от Ach вазодилатация (фиг. 5в, г) при 4-HCD мишки (фиг. (Фиг. 5г). 5г). Реакционната способност към Ach обаче остава чувствителна към индометацин (COX-зависима) при 4-HCD мишки, както при 2-HCD.
- Влияние на приема на протеини от майката с храната върху оцеляването, растежа и развитието на плода
- Как влияе храненето на тийнейджърите върху растежа, развитието и обучението здравословно
- За развитието на е необходимо хранене с големи молекули протеин през сучещия период
- Хранене на колибри Разработване на пречистена диета за дългосрочна поддръжка - Брис - 1989 - Зоопарк
- Ionic - Разработка на мобилни приложения на различни платформи