Екатерина А. Семенова
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Мин-чул Куон
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Ким Монкхорст
2 Отдел по патология, Холандският институт за рак, Амстердам 1066 CX, Холандия
Ji-Ying Song
3 Отдел по експериментална патология на животните, Холандският институт за рак, Амстердам 1066 CX, Холандия
Раджит Баскаран
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
8 Genomics Core Facility, Холандският институт за рак, Амстердам 1066 CX, Холандия
Оскар Криджгсман
5 Отдел по молекулярна онкология, Холандският институт за рак, Амстердам 1066 CX, Холандия
Томас Куилман
5 Отдел по молекулярна онкология, Холандският институт за рак, Амстердам 1066 CX, Холандия
Денис Питърс
4 Основно съоръжение за молекулярна патология и биобанкиране, Холандският институт за рак, Амстердам 1066 CX, Холандия
Wieneke A. Buikhuisen
6 Отдел по торакална онкология, Холандският институт за рак, Амстердам 1066 CX, Холандия
Егберт Ф. Смит
6 Отдел по торакална онкология, Холандският институт за рак, Амстердам 1066 CX, Холандия
Колин Причард
7 Клиника за мишки за изследване на рак и стареене, Трансгенно ядро, Холандски институт за рак, Амстердам 1066 CX, Холандия
Миранда Козийнсен
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Ян ван дер Влиет
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Джон Зевенховен
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Ян-Пол Ламбуй
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Натали Проуст
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Ервин ван Монфор
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
Арно Велдс
8 Genomics Core Facility, Холандският институт за рак, Амстердам 1066 CX, Холандия
Иво J. Huijbers
7 Клиника за мишки за изследване на рак и стареене, Трансгенно ядро, Холандски институт за рак, Амстердам 1066 CX, Холандия
Антон Бърнс
1 Отдел по молекулярна генетика, Холандският институт за рак, Амстердам 1066 CX, Холандия
9 Институт за наука и технологии „Сколково“, Москва 143026, Русия
Свързани данни
Обобщение
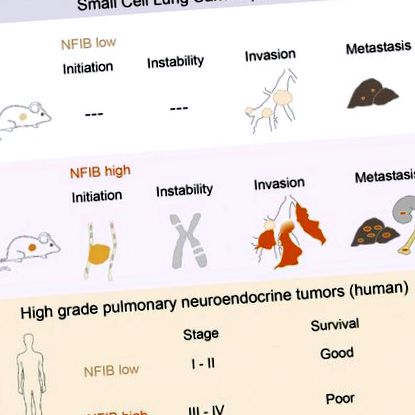
Дребноклетъчният рак на белия дроб (SCLC) е агресивен невроендокринен тумор и до момента няма налично ефективно лечение. Моделите на мишки на SCLC, базирани на инактивирането на Rb1 и Trp53, показват чести амплификации на гените Nfib и Mycl. Тук съобщаваме, че въпреки че свръхекспресията на двата транскрипционни фактора ускорява растежа на тумора, NFIB специално насърчава метастатичното разпространение. Високите нива на NFIB са свързани с експанзивен растеж на слабо диференцирана и почти изключително E-кадхерин (CDH1) -негативна инвазивна туморна клетъчна популация. В съответствие с данните на мишките, ние откриваме, че NFIB е свръхекспресиран в почти всички тествани човешки метастатични високостепенни невроендокринни белодробни тумори, което налага по-нататъшна оценка на NFIB като маркер за прогресия на тумора в клинична обстановка.
Графичен резюме
Въведение
Дребноклетъчният рак на белия дроб (SCLC) е най-агресивният подтип на рак на белия дроб и се характеризира с ранно метастатично разпространение в множество органи (Byers and Rudin, 2015). Най-често се диагностицира в напреднал стадий на заболяването и обикновено е фатален в рамките на 4 месеца, ако не се лекува. Друга поразителна черта на SCLC е неговият изключителен първоначален отговор на стандартните схеми на химиотерапия от първа линия, който е последван от бърз рецидив на химиорезистентни тумори, ограничавайки ползата за оцеляване на пациентите с SCLC (Byers and Rudin, 2015). Резултатите от многобройни клинични изпитвания, тестващи различни терапевтични подходи за SCLC, са разочароващи и програмите за лечение не са се променили през последните три десетилетия (Byers and Rudin, 2015). Поради метастатичния си характер при представяне, SCLC рядко се резецира, което води до недостиг на туморен материал за анализ. В този контекст миши модели на SCLC предоставят мощен инструмент за изучаване на биологията на SCLC иницииране, прогресия и механизми на резистентност (Kwon and Berns, 2013).
Преди това сме генерирали миши модел на SCLC, базиран на условно инактивиране на туморни супресорни гени, Trp53 и Rb1, и двата от които са изтрити в почти всички случаи на SCLC при хора (George et al., 2015, Meuwissen et al., 2003). Моделът рекапитулира много забележителни характеристики на SCLC, включително неговата локализация, метастатична прогресия и хистопатологични характеристики (Gazdar et al., 2015, Meuwissen et al., 2003). В този модел повтарящите се генетични промени включват загуби на хромозоми 8, 12, 14, 16 и 19 и както печалби, така и загуби на хромозома 4 (Dooley et al., 2011, McFadden et al., 2014). Те вероятно осигуряват селективно предимство на туморните клетки по време на еволюцията на тумора и могат да съдържат драйвери на гени в случай на генна амплификация. По-специално хромозома 4 често показва редица геномни промени, като фокални делеции, обхващащи miR200a/miR200b, косматият усилвател на разделено семейство транскрипционни фактори (Hes2, Hes3 и Hes5), Trp73 и две фокални амплификации, едното включва Mycl и друго Nfib (Calbo et al., 2011, McFadden et al., 2014).
MYCL е транскрипционен фактор с основна спирала-верига-спирала, за който се съобщава, че е онкоген в SCLC. Няколко проучвания, прилагащи секвениране на екзоми и цели геноми, съобщават за повтарящо се усилване на MYC семейството онкогени, включително MYCL в SCLC (6,9% -9%) (Calbo et al., 2011, George et al., 2015, Iwakawa et al., 2013 ). В съответствие с това наблюдение, целенасочената свръхекспресия на Mycl в модел на мишка значително ускори развитието на тумора (Huijbers et al., 2014).
NFIB принадлежи към семейството на транскрипционните фактори на ядрения фактор 1 (NFI). Те бяха открити като фактори от съществено значение за репликацията на аденовирус, но сега е известно, че контролират експресията на голям брой клетъчни гени (Gronostajski, 2000, Harris et al., 2015). Четирите членове на гръбначните животни, NFIA, NFIB, NFIC и NFIX, могат да се свързват като хетеро и хомодимери към симетричната консенсусна последователност на TTGGC (N5) GCCAA и да активират или потискат транскрипцията в зависимост от контекста (Harris et al., 2015) . Те се изразяват в множество органични системи в частично припокриващи се модели и играят важна роля в регулирането на специфични за тъканите програми за експресия (Harris et al., 2015). NFIB регулира пролиферацията и диференциацията на епитела по време на съзряването на белите дробове, а нокаутиращите животни на NFIB имат тежка белодробна хипоплазия и дефекти в развитието на мозъка (Hsu et al., 2011, Steele-Perkins et al., 2005). Освен това се съобщава, че координира пролиферацията и диференциацията на стволови клетки от епителни меланоцити в космените фоликули, където е показано, че регулира експресията на 1449 целеви гени (Chang et al., 2013). В мозъка NFIB регулира диференциацията на нервните прогениторни клетки (Piper et al., 2014).
Няколко доклада определят NFIB като онкоген (Dooley et al., 2011, Zhang et al., 2015). Хромозомният регион, кодиращ NFIB, се усилва при пациенти с тройно отрицателен рак на гърдата (Han et al., 2008), при пациенти с плоскоклетъчен карцином на хранопровода (Yang et al., 2001) и при карцином на подмандибуларната жлеза (Andreasen et ал., 2016). Повишени нива на NFIB се откриват и в метастатични гигантски клетъчни тумори на костите и са свързани с повишен риск от метастази (Mosakhani et al., 2013, Quattrini et al., 2015). Използвайки SCLC клетъчни линии както от пациенти, така и от модели на мишки, беше показано, че NFIB регулира апоптозата, стареенето и пролиферацията и дава възможност за независим от закотвянето растеж на фибробластите (Dooley et al., 2011).
За разлика от гените на семейството MYC, NFIB се усилва в много ограничен брой случаи на човешки SCLC (George et al., 2015, Iwakawa et al., 2013). Имайки предвид високата честота на фокалното му усилване при мишки и онкогенния потенциал in vitro, решихме да тестваме как експресията на NFIB влияе върху развитието на SCLC in vivo и да изследваме потенциалната му роля при SCLC при хора.
Резултати
NFIB ускорява стартирането и прогресирането на SCLC
- Отслабване и рецидив на рака на гърдата Малки стъпки могат да направят голяма разлика Ракът на гърдата
- Лекарството за отслабване, извикано след изпитвания, открива връзка с рак на дебелото черво, панкреаса и белия дроб
- Туморният некротичен фактор α е определящ фактор за патогенезата и прогресирането на заболяването при микобактериите
- „Отслабване“ на туморни клетки регулира прогресията на тумора чрез PLCL1UCP1-медиирано липидно Браунинг - Xiong
- Отслабване - Как да отслабнем и да останем стройни с хомеопатията и солите на Schuessler (клетъчни соли)