Андреас Т. Гюнтнер
1 Лаборатория за технологии за частици, Катедра по машинно и технологично инженерство, ETH Цюрих, CH-8092 Цюрих, Швейцария; hc.zhte.tneduts@okailuj (J.F.K.); hc.zhte.tneduts@hsidnal (H.L.); hc.zhte.tneduts@rodoehtj (S.J.T.); [email protected] (S.E.P.)
Julia F. Kompalla
1 Лаборатория за технологии за частици, Катедра по машинно и технологично инженерство, ETH Цюрих, CH-8092 Цюрих, Швейцария; hc.zhte.tneduts@okailuj (J.F.K.); hc.zhte.tneduts@hsidnal (H.L.); hc.zhte.tneduts@rodoehtj (S.J.T.); [email protected] (S.E.P.)
Хенинг Ландис
1 Лаборатория за технологии за частици, Катедра по машинно и технологично инженерство, ETH Цюрих, CH-8092 Цюрих, Швейцария; hc.zhte.tneduts@okailuj (J.F.K.); hc.zhte.tneduts@hsidnal (H.L.); hc.zhte.tneduts@rodoehtj (S.J.T.); [email protected] (S.E.P.)
С. Джонатан Теодор
1 Лаборатория за технологии за частици, Катедра по машинно и технологично инженерство, ETH Цюрих, CH-8092 Цюрих, Швейцария; hc.zhte.tneduts@okailuj (J.F.K.); hc.zhte.tneduts@hsidnal (H.L.); hc.zhte.tneduts@rodoehtj (S.J.T.); [email protected] (S.E.P.)
Бетина Гайдл
2 Катедра по ендокринология, диабет и клинично хранене, Университетска болница Цюрих, CH-8091 Цюрих, Швейцария; [email protected]
Нориан А. Сиеви
3 Отделение по пулмология, Университетска болница Цюрих, CH-8091 Цюрих, Швейцария; [email protected] (N.A.S.); [email protected] (M.K.)
Малкълм Колер
3 Отделение по пулмология, Университетска болница Цюрих, CH-8091 Цюрих, Швейцария; [email protected] (N.A.S.); [email protected] (M.K.)
Сотирис Е. Працинис
1 Лаборатория за технологии за частици, Катедра по машинно и технологично инженерство, ETH Цюрих, CH-8092 Цюрих, Швейцария; hc.zhte.tneduts@okailuj (J.F.K.); hc.zhte.tneduts@hsidnal (H.L.); hc.zhte.tneduts@rodoehtj (S.J.T.); [email protected] (S.E.P.)
Филип А. Гербер
2 Катедра по ендокринология, диабет и клинично хранене, Университетска болница Цюрих, CH-8091 Цюрих, Швейцария; [email protected]
Свързани данни
Резюме
Кетогенната диета (KD; високо съдържание на мазнини, ниско съдържание на въглехидрати) е стандартно лечение за затлъстяване, неврологични заболявания (напр. Рефрактерна епилепсия) и обещаващ метод за спортисти за подобряване на тяхната издръжливост. При това нивото на кетоза трябва да се регулира плътно, за да се осигури ефективна терапия. Тук представяме компактен и евтин сензор за дишане за наблюдение на кетоза онлайн и неинвазивно. Сензорът се състои от легирани с Si наночастици WO3, които детектират селективно ацетон на дъха с характеристики на нелинейна реакция в съответния диапазон от 1 до 66 ppm, както е идентифицирано чрез масспектрометрия. Когато се тества върху единадесет субекта (пет жени и шест мъже), подложени на 36-часов KD, базиран на протокола на Джон Хопкинс, този сензор ясно разпознава появата и прогресията на кетозата. Това е в добро съгласие с измерванията на β-хидроксибутират на капилярна кръв (BOHB). Въпреки подобни диетични условия, са наблюдавани и правилно идентифицирани от сензора силни различия в динамиката на кетозата между участниците. Те дори включват модели на дишане на ацетон, които могат да бъдат свързани с ниска толерантност към тази диета. В резултат на това този преносим сензор за дишане представлява лесно приложима и надеждна технология за наблюдение на KD, вероятно по време на медицинско лечение на епилепсия и загуба на тегло.
1. Въведение
Кетогенната диета (KD, високо съдържание на мазнини при нисък прием на въглехидрати и нисък прием на протеини) е доказано медицинско лечение на рефрактерна епилепсия (т.е. резистентна към лекарства) [1], протичаща в
30% от прибл. 50 милиона епилептици по целия свят [2]. Също така, това е ефективна терапия за отслабване [3] с нарастващ интерес за лечение на свързани със затлъстяването метаболитни нарушения [4] (напр. Диабет [5] или мастно-чернодробно заболяване [6]), действа противовъзпалително [7] и дори е полезно за спортистите да подобрят своите показатели за издръжливост чрез промяна на предпочитанията за гориво [8]. По време на KD, консумацията на енергия от тялото се прехвърля от глюкоза като основно гориво към производството и използването на кетонни тела [9], докато само умереният прием на протеин трябва да ограничи глюконеогенезата от аминокиселини [10]. По-конкретно, ацетоацетатът (AcAc) е такова кетонно тяло, образувано в чернодробните митохондрии след β-окисление на мастни киселини и допълнителни биохимични трансформации (Фигура 1а, каре) [9]. Скоростта му на производство се определя и от наличието на митохондриална 3-хидрокси-3-метил-глутарил-коензим А (HMG-CoA) синтаза, индуцирана от гладно, цикличен аденозин монофосфат (cAMP) и мастни киселини [11]. Други кетони са β-хидроксибутират (BOHB) и летлив ацетон, получени от AcAc чрез обратимо ензимно разграждане и спонтанно декарбоксилиране, съответно [9].
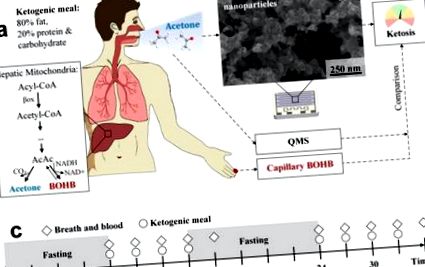
(а) Участниците, подложени на KD, с повишена кетогенеза. В него ацетонът и BOHB се образуват с повишени скорости чрез метаболизиране на свободни мастни киселини в чернодробните митохондрии (кутия). Ацетонът е летлив и може да се измерва неинвазивно при издишване, докато нелетливият BOHB може да се определи чрез анализ на капилярна кръв. За да се посочи състоянието на кетоза, дихателният ацетон се измерва със специално изработени и евтини химиорезистивни сензорни филми (б). Те се състоят от агломерирани и агрегирани допирани с Si наночастици WO3, както е посочено от SEM (изглед отгоре). Резултатите от сензорите се сравняват с паралелни измервания на дихателен ацетон чрез QMS и капилярна кръв BOHB. (° С) Експериментален протокол: Доброволците поглъщат общо 8 кетогенни ястия на всеки 3 часа (кръгове) в два последователни дни. Дишането и капилярната кръв се анализират 10 пъти, винаги непосредствено преди кетогенните ястия и в края на всеки измервателен ден. Преди и между двата дни се извършва гладно през нощта (засенчено в сиво).
По време на KD се желае често наблюдение, за да се гарантира устойчивостта на кетогенното състояние. Понастоящем това се прави предимно чрез измерване на AcAc или BOHB в урината или кръвта [12]. Въпреки точността на анализа на кръвта, той не е идеален за често наблюдение поради своята инвазивност и цена. Анализът на урината също има недостатъци, по-специално неговата ниска точност поради различни фактори като хидратация на пациентите и киселинно-алкален баланс [13]. Измерването на издишан ацетон е обещаваща алтернатива, като дъхът винаги е достъпен по неинвазивен начин [14]. В действителност, измерванията на 12 здрави възрастни показват увеличение на нивата на ацетон в дъха от средно 0,7 до 2,5 ppm след 12-часов KD, корелиращ добре с плазмения BOHB и AcAc в урината [12], подобна тенденция, наблюдавана в други проучвания [15]. Това е още по-изразено при деца с епилепсия, които могат да следват KD в продължение на няколко месеца, достигайки концентрации на ацетон в дъха> 100 ppm [16]. Най-важното е, че всички проучвания съобщават за силни разлики между субектите в кетогенните профили при същите диетични условия [12,15,16], подчертавайки необходимостта от често и индивидуално наблюдение, за да се осигури персонализирана обратна връзка.
Като цяло събирането на повтарящи се измервания на биомаркери, техният анализ и интерпретация, служещи като основа за индивидуализирани здравни препоръки, се счита за един от най-обещаващите инструменти на съвременната персонализирана медицина. Понастоящем само няколко такива системи са клинично достъпни, но е доказано, че те са по-добри в сравнение с традиционните системи. Пример е непрекъснатото измерване на глюкозата при пациенти с диабет с полуавтоматизирани системи, насочващи инсулиновата терапия [17].
Въпреки изключителната си чувствителност и селективност, приложените методи, базирани на масова спектрометрия (напр. GC-FID [12,16], GC-MS [18], SIFT-MS [15]) са доста обемисти, скъпи и изискват обучен персонал, който пречи на приложение като лични детектори на ацетон за дъх в ежедневието. По-подходящи са химическите газови сензори, например, базирани на химиорезистивни метални оксиди. Те се прилагат вече при наблюдение на въздуха в помещенията с типични разходи за единица от няколко щатски долара (например Figaro TGS 813 за горими газове [19]). Това се позволява от мащабируеми и съвместими с CMOS технологии за производството на сензорни филми. По-конкретно, тяхната сензорна структура може да се отглежда [20] или да се депозира (напр. Чрез термофореза от пламъчни аерозоли [21] или лечебно острие [22]) директно върху микрообработени чипове, което води до компактни сензори за готов интегриране в ръчни устройства [23]. Освен това тяхната морфология на филма и отложената маса могат да бъдат оптимизирани по време на производството чрез отчитане на съпротивление на място [24]. Когато са наноструктурирани, такива сензори проявяват висока чувствителност за откриване дори на ниски концентрации на ppb аналит [21]. Независимо от това, селективността спрямо други издишани съединения, които могат да се появят при по-високи концентрации, остава основно предизвикателство.
Тук се тестват компактни сензори, базирани на легирани с Si наночастици WO3, за да се наблюдава кетоза по време на 36-часова кетогенна диета, базирана на протокола на Джон Хопкинс [36] (Фигура 1). Заедно с пробовземач за екстракция на дишане в края на прилива [28], тези сензори се прилагат върху единадесет доброволци (пет жени и шест мъже), за да се наблюдават техните индивидуални ацетонови профили на дишане. Сензорните отговори се сравняват тясно с квадруполната масспектрометрия (СМК), за да се идентифицират чувствителните характеристики при повишени концентрации на ацетон на дъха до 66 ppm. Едновременният анализ на капилярна кръв (BOHB и глюкоза) се извършва като еталон.
2. Материали и методи
2.1. Изработване на сензор за ацетон и характеризиране на филма
2.2. Анализ на дишането и кръвта
Дишането в края на приливите и отливите се извлича по контролиран и възпроизводим начин със специално изработен и модулен пробоотборник, илюстриран и описан подробно на друго място (Фигура 1а в справка [28]). Накратко, той се състоеше от вход за измерване на налягането в дихателните пътища и насочване на издишвания поток чрез визуално подсказване и отворена тръба за издишване за улавяне и буфериране на дишането в края на прилива. Доброволците бяха помолени да издишват в продължение на 30 s през мундщук за еднократна употреба в пробовземача, като същевременно поддържат налягане в дихателните пътища от 980 Pa (съответстващо на 50 ml s -1 поток на издишване), както се препоръчва от Американското торакално и европейско дихателно общество за вземане на проби от NO 38]. СО2 (Capnostat 5, Respironics, Murrysville, PA, USA) беше използван, за да се провери дали доброволецът е достигнал до края на приливното дишане (CO2> 3% [39]) в края на издишването. Дишането се анализира онлайн чрез насочване на проби през нагрята трансферна линия към ацетоновия сензор и масспектрометър за кръстосано валидиране. Всички повърхности в контакт с дъха се състоят от инертен тефлон и се нагряват (65 ° C), за да се избегне кондензация на вода и адсорбция на аналита.
Сензорът за ацетон е монтиран на държач на Macor, монтиран в тефлонова камера (показана на фигура 1а от [40]) и подаван със 130 ml min -1 от пробника с помпа (SP 135 FZ, Schwarzer Precision, Essen, Германия ). За оптимална селективност и чувствителност, ацетоновият сензор се нагрява до 350 ° C [40] чрез прилагане на постоянно напрежение (R&S HMC8043, HAMEG, Майнхаузен, Германия) през нагревател Pt, разположен на гърба на основите, като същевременно следи температурата с устойчивост детектор за температура отпред. Съпротивлението на сензорния филм непрекъснато се измерва и записва с мултиметър (Keithley 2700, Keithley Instruments, Solon, OH, USA). Отговорът на сензора S е дефиниран като [29]
като R a i r и R b r e a t h са съпротивленията на сензора във фонов стаен въздух и съответно при излагане на дъх,.
Допълнителна линия беше свързана непосредствено преди камерата на сензора за ацетон за извличане на проби за СУК (QMS 422, ThermoStar TM, Pfeiffer Vacuum, Asslar, Германия). Напрежението на вторичния електронен умножител беше зададено на 950 V, докато аналитичният блок беше загрят до 150 ° C. За откриване на ацетон, йонният ток при съотношение маса-заряд 58,0 беше измерен с време на престой 0,2 s и разделителна способност 200. СУК беше калибриран с 9-точкови криви на еднокомпонентен ацетон в диапазона от 0,5 до 50 ppm в синтетичен въздух при 90% RH. Сертифициран ацетонов цилиндров газ (13,6 ppm в синтетичен въздух, Pan Gas, за концентрации ≤ 1 ppm и 500 ppm в синтетичен въздух, Pan Gas, за концентрации> 1 ppm) се разрежда във овлажнен синтетичен въздух (Pan Gas 6,0, CnHm и NOx ≤ 100 ppb) със смесителна настройка, описана другаде [32]. Капилярна кръв се взема чрез пробождане с пръст с ланцетни писалки. BOHB и глюкозата се определят с FreeStyle Neo Precision (Abbott Diabetes Care, Alameda, CA, USA).
2.3. Протокол за изследване
Всяко кетогенно хранене се състои от сметана за разбиване на 35% мазнини (Coop, Базел, Швейцария) и прахообразна протеинова добавка с вкус на шоколад (Sponsor Whey Protein 94, Wollerau, Швейцария), за да се постигне общо съдържание на мазнини от 80 тегловни%. Съответният макронутриционен състав на двата продукта е обобщен в таблица 1. Четири хранения представляват 75% от 24-часовите енергийни разходи (24-EE в kcal/d) от дневните нужди от калории на индивида, определени чрез умножаване на енергийните разходи в покой (REE) на всеки доброволец с фактора на физическа активност. REE се изчислява, като се използва преработената формула на Харис-Бенедикт [41], която предоставя доста точна оценка при лица без наднормено тегло [42]. Факторът на физическа активност се основава на физическата активност по време на работа и свободно време [43].
маса 1
Състав на макроелементи на кетогенни ястия.
- Как да проследявате резултатите от кетогенната диета - Перфектното кето
- Как да използваме кетогенната диета за подобряване на телесния състав - InBody USA
- Цикличната кетогенна диета за мускулно покачване или загуба на мазнини (циклична кетогенна диета групира и
- Кетогенната диета добра или лоша е за мигрена; Новини-Медицински
- Как кетогенната диета и периодичното гладуване излекуваха моята недиабетна хипогликемия от Джулия Одом