Резюме
Заден план
Болестта на Алцхаймер (AD) е прогресивно невродегенеративно разстройство, което засяга предимно възрастните хора. Проучванията както на хора, така и на животински модели свързват консумацията на холестерол и наситени мазнини с отлагането на амилоид-β (Ар) и развитието на AD. И все пак, тези проучвания не изследват диети с високо съдържание на мазнини в комбинация с намален прием на въглехидрати. Тук тествахме ефекта от диета с високо съдържание на наситени мазнини/ниско съдържание на въглехидрати върху трансгенен модел на мишка на AD.
Резултати
Започвайки от тримесечна възраст, две групи женски трансгенни мишки, носещи APP мутация (Лондон) (APP/V717I), бяха хранени или със стандартна диета (SD), съставена от високо съдържание на въглехидрати/нискомаслена чау, или с кетогенна диета (KD ), съставен от чау с много ниски въглехидрати/високо наситени мазнини в продължение на 43 дни. Животните, хранени с KD, показват силно повишени нива на серумен кетон в тялото, измерено чрез β-хидроксибутират (3.85 ± 2.6 тМ), в сравнение с животни, хранени със SD (0.29 ± 0.06 тМ). В допълнение, животните, хранени с KD, са загубили телесно тегло (SD 22,2 ± 0,6 g спрямо KD 17,5 ± 1,4 g, p = 0,0067). За разлика от по-ранните проучвания, краткият режим на хранене с KD значително намалява общите нива на Aβ в мозъка с приблизително 25%. Въпреки промените в нивата на кетоните, телесното тегло и нивата на Ар, KD диетата не променя поведенческите мерки.
Заключение
Предишни проучвания предполагат, че диетите, богати на холестерол и наситени мазнини, увеличават отлагането на Ар и риска от развитие на АД. Тук демонстрираме, че диета, богата на наситени мазнини и ниско съдържание на въглехидрати, всъщност може да намали нивата на Ар. Следователно диетичните стратегии, насочени към намаляване на нивата на Ар, трябва да вземат предвид взаимодействията на диетичните компоненти и метаболитните резултати, по-специално трябва да се имат предвид нивата на въглехидрати, общите калории и наличието на кетонни тела.
Заден план
Развитието на AD и натрупването на Aβ са свързани с диетични фактори. Диетите, богати на наситени мазнини, са били многократно замесени в епидемиологични проучвания [5–8], въпреки че са били трудни за възпроизвеждане [9]. В допълнение, няколко експеримента с модели на мишки изглежда потвърждават връзката между богатата на липиди диета и AD. Използвайки трансгенни миши модели на AD, няколко групи съобщават, че диети с високо съдържание на мазнини или диети с добавен холестерол повишават нивата и отлагането на Ар пептида [10-14]. Тези проучвания обаче не изследват ефектите на диети, богати на липиди, в комбинация с нисък прием на въглехидрати.
Известно е, че диетите, които съдържат много ниско съдържание на въглехидрати и високо съдържание на мазнини, предизвикват чернодробното производство на кетонни тела (β-хидроксибутират, ацетоацетат и ацетон) и често се наричат кетогенни диети (KD). Кетогенните диети в някои аспекти имитират глад и са разработени за използване при хора за лечение на епилепсия въз основа на дългите наблюдения, че гладуването намалява гърчовете (за преглед вж. [15]). Експерименталният KD е калорично ограничен и има фиксиран състав и по този начин се различава от диетите с ниско съдържание на въглехидрати, използвани за отслабване, които обикновено са ad lib и променлив в състава. Въпреки тези разлики, диетите с ниско съдържание на въглехидрати също могат да бъдат ефективни за предотвратяване на гърчове и могат да работят чрез подобни механизми като KD [16]. Точният механизъм за антиконвулсивните свойства на тези диети все още е неизвестен. Ниското съдържание на въглехидрати и при двете диети предизвиква множество метаболитни промени, които могат да бъдат защитни, като повишени нива на циркулиращото кетонно тяло, повишено окисление на мазнините, промени в метаболизма на протеините и промени в генната експресия [17, 18].
Резултати
Настоящото проучване тества експериментално ефектите на KD, съставен от изключително ниско съдържание на въглехидрати и много високо съдържание на наситени мазнини в трансгенния миши модел на AD. Мишките експресират човешки APP ген, съдържащ "Лондонската" APP мутация (APP/V717I), задвижван от ти-1 ген промотор. Трансгенните мишки APP/V717I произвеждат значителни нива на разтворим Ар в мозъка още на 3-месечна възраст и проявяват екстензивно отлагане на плаки до 12-14 месеца. Животните демонстрират ранни поведенчески дефицити и представляват модел на фамилна AD с ранно начало [19].
Хранени бяха 16 женски мишки APP/V717I ad libitum на стандартна диета (SD), състояща се от чау с високо съдържание на въглехидрати/ниско съдържание на мазнини (Muracon-G чау: 35% въглехидрати, 21% протеини, 4,5% мазнини, 39,5% вода, фибри и пепел). Преобладаващата мастна киселина в Muracon-G е линолевата киселина (18: 2) и тя съдържа 1,4% от теглото на чау. На тримесечна възраст половината от групата (8 животни) е преминала на кетогенна диета (KD), състояща се от много ниско съдържание на въглехидрати/високо съдържание на мазнини, докато останалите 8 животни остават на SD. И в двата случая животните са имали свободен достъп до чау по всяко време и приемът не е бил експериментално ограничен. За KD използвахме Bio-Serv Inc. F3666 чау: 0,76% въглехидрати, 8% протеини, 79% мазнини, 12% вода, фибри и пепел. F3666 е кетогенна чау, съставена от свинска мас, маслена мазнина, декстроза, казеин, фибри, царевично масло, минерална смес и витаминна смес. F3666 е богат на наситени мазнини. Повече от 29% от чау F3666 се състои от наситени мазнини по тегло: 2,4% миристинова киселина (C14: 0), 18,9% палмитинова киселина (C16: 0) и 8,4% стеаринова (C18: 0) (вж. Таблица 1) . Животните, хранени с чау F3666, са посочени като група KD. Мишките, останали на чау Muracon-G, се наричат SD група.
KD диета и отслабване
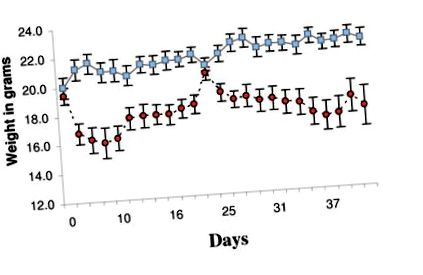
През първите 7 дни много от животните в групата на KD не са склонни да ядат новата чау и са загубили тегло (Фигура 1). За да се подобри консумацията и да се смекчи загубата на тегло, SD чау се смесва с KD чау в съотношение 1: 3, започвайки от ден 16 до ден 20. За седемте дни след ден 20 количеството SD чау е намалено до няколко трохи, поръсени върху KD чау. След 28 ден животните бяха върнати само в KD chow. Смесеният чау възстановява телесното тегло на групата KD до приблизително нивото на групата SD, на около 20 грама (Фигура 1). Когато животните се хранят изключително с KD чау, телесното тегло отново спада, но има тенденция да се стабилизира на приблизително 18 грама (Фигура 1). В края на експеримента средните тегла бяха значително различни (SD 22,2 ± 0,6 g спрямо KD 17,5 ± 1,4 g, p = 0,0067).
Средно тегло в грамове за всяка група по време на експеримента. Сините квадратчета представляват стандартна диета (SD) група. Червените кръгове представляват кетогенна диета (KD) група. Лентите за грешки представляват стандартна грешка на средната стойност. Дните означават време в дни от началото на промяната в диетата. Животните на KD отслабнаха. За да се смекчи загубата на тегло и да се подобри храненето, малко количество SD чау се смесва с KD чау през втората седмица и след това се отстранява през третата седмица, вижте методите.
KD диетата повишава серумните нива на β-хидроксибутират
За да се измери ефективността на чау за индуциране на кетогенно състояние, се вземат кръвни проби седмично и се изследват за нива на β-хидроксибутират (BHB). Осем дни след смяната на чау животните в групата на KD са имали значително повишени нива на BHB в сравнение с групата SD (SD 0,26 ± 0,023 mM срещу KD 8,94 + 1,8 mM, p Фигура 2
Когнитивно тестване
След 38 дни на диета животните бяха тествани за поведенчески дефицити с помощта на тестове за разпознаване на обекти, както беше описано по-рано [20], вижте методи. Въпреки разликите в чау, нивата на BHB и загубата на тегло, не е установена разлика в поведенческите мерки между групите (Таблица 2).
Ар нива
На четиримесечна възраст APP/V717I мишки не притежават Ар положителни плаки и целият Ар присъства в разтворимата фракция [19]. Следователно, 43 дни след диетични промени в нивата на разтворим Ар в мозъка са измерени и в двете групи животни. Мозъчен хомогенат е изолиран, както е описано по-рано [20], виж методите. Едно полукълбо от всяко животно беше анализирано както за Aβ 40, така и за 42 нива, използвайки Amyloid Aβ40 или Aβ42 ELISA Kit за висока чувствителност (The Genetics Company, Цюрих, Швейцария). Установено е, че нивата на разтворими Ар 40 и 42 са значително по-ниски в групата, хранена с KD (Фигура 3). В случаите на фамилна АД се образува излишък Ар42 спрямо А40, като по този начин се увеличава съотношението Ар 42/40. Изследвахме съотношението между Aβ42 и Aβ40 и не открихме разлика между групите (SD 0,51 ± 0,024 срещу KD 0,56 ± 0,026, p = 0,2872), което предполага, че диетата не променя местата на разцепване на APP, а вместо това насърчава общо понижаване на Aβ вид.
Кетогенната диета намалява Aβ40 и Aβ42. Aβ нива като ng/g на мозъчната тъкан. Групата със стандартна диета (SD) е показана в синьо, групата с кетогенна диета (KD) е показана в червено, лентите с грешки представляват стандартна грешка на средната стойност. SD чау Aβ40 1,72 ± 0,12 ng/g срещу KD чау Aβ40 1,28 ± 0,09 ng/g, p = 0,012. SD чау Aβ42 0,88 ± 0,05 ng/g срещу KD чау Aβ42 0,71 ± 0,0,4 ng/g, p = 0,016.
Общите нива на протеини бяха изследвани, за да се определи дали общ спад в мозъчния протеин в групата на KD може да обясни намаляването на нивата на Ар. Нивата на протеин, измерени като mg/ml мозъчен хомогенат, не се различават между двете групи (SD 0,56 ± 0,035 mg/ml спрямо KD 0,51 ± 0,017 mg/ml, p = 0,213). Тъй като повечето (макар и не всички) от животните в групата на KD са отслабнали, може да се очаква животните с най-голяма загуба на тегло да имат най-ниските нива на Ар. Нивата на Aβ40 или Aβ42 обаче не корелират с промяна на теглото във всички групи (Aβ40 r = 0,16, p = 0,20; Aβ42 r = 0,05, p = 0,49) или само в групата на KD (Aβ40 r
Дискусия
Това проучване демонстрира неочаквания резултат, че кратко лечение с диета с ниско съдържание на въглехидрати/високо наситени мазнини намалява общите нива на Ар в миши модел на болестта на Алцхаймер. Предишни проучвания предполагат, че диетите, богати на наситени мазнини или холестерол, повишават както производството, така и отлагането на Ар в миши модели на AD, което води до предположението, че диетите, богати на липиди, са фактор за AD [10, 12-14]. Тези диети обаче не бяха диети с ниско съдържание на въглехидрати. При диетите с висок холестерол, холестеролът се добавя към диетата без намаляване на други компоненти [10, 14]. При проучванията на диети с високо съдържание на мазнини, съдържанието на въглехидрати все още е относително високо. Например Хо и др. използвал диета от 60% мазнини, 20% въглехидрати, 20% протеини. Тази диета е била достатъчно богата на въглехидрати, за да доведе до големи увеличения на телесното тегло при животните [11].
Известно е, че взаимодействието на различни макронутриенти, по-специално мазнини и въглехидрати, влияе върху метаболитното състояние на животното. Например Марсет-Балиери и др. изследва дали мазнините само в диетата са достатъчни, за да изместят енергийния баланс към съхранението на мазнини. И все пак, плъхове хранени ad libitum диетите с високо съдържание на мазнини (50%), лишени от въглехидрати, не увеличават енергийния прием и не увеличават телесното затлъстяване, докато животните, хранени с високомаслени диети (30%) в присъствието на въглехидрати (56%), увеличават енергийния прием и натрупват телесни мазнини [21]. Такива изследвания подкрепят виждането, че когато мазнините и въглехидратите се консумират едновременно, въглехидратите стимулират секрецията на инсулин и по този начин насърчават съхранението на мазнини (за скорошен преглед вж. [22]). Ето защо е важно да се вземе предвид профилът на макронутриенти в диетата, когато се изследват ефектите на хранителните мазнини върху биологичните процеси.
В настоящото проучване се хранят трансгенни животни ad libitum диета с много високо съдържание на мазнини (79%), която на практика е била лишена от въглехидрати (0,76%). KD води до производство на кетон в тялото, загуба на тегло и намаляване на нивата на Ар. Следователно, данните, представени тук, предполагат, че може да не мазнините в диетата повишават нивата на Ар, а може би нивата на общите калории, въглехидратите или метаболитното състояние на животното.
Настоящото проучване показва, че противно на очакванията, трансгенни мишки са хранени ab libitum диета с много ниско съдържание на въглехидрати/високо наситени мазнини представя по-ниски нива на Ар след само 43 дни диетична промяна. Групата с KD показва ниски нива както на Aβ40, така и на по-амилоидните Aβ42, което предполага, че KD диетата не променя или увеличава ефективността на местата на разцепване в APP. Вместо това данните предполагат, че режимът на KD или намалява обработката на APP, или увеличава деградацията на Aβ видове. Повечето от животните, прилагащи кетогенна диета, губят телесно тегло, както и показват намалени нива на Ар. Въпреки това, намалените нива на Ар може да не се дължат на общо понижаване на съдържанието на протеин. Общите нива на мозъчен протеин не се различават между групите, а нивата на Ар не корелират със загубата на тегло. Интересното е, че въпреки промяна в диетата, загуба на тегло и нива на Ар, не се наблюдава промяна в когнитивните показатели (Таблица 2). Това наблюдение е в съгласие с общата констатация, че диетите с KD не са вредни за мишките [23]. Също така констатацията, че намаляването на Ар не е подобрило когнитивните показатели, може да се дължи на умереното понижаване на нивата при тези условия и може да се наложи по-продължително лечение.
Диетата KD е разработена, за да имитира реакция на глад при животните, без да намалява калориите до вредни нива [15]. По този начин KD е подобен на режимите за ограничаване на калориите (CR), които са били използвани при много видове за промяна на стареенето и повишаване на някои форми на устойчивост на стрес. CR обикновено намалява калориите с 30-40% в сравнение с ad libitum хранени животни и има многобройни положителни ефекти върху здравето на животните [24]. В настоящото проучване не се опитахме да ограничим калориите по никакъв начин и животните имаха свободен достъп до кетогенната чау по всяко време и приемът беше самоограничен. Тъй като обаче животните първоначално не са склонни да ядат KD чау и наблюдаваме загуба на тегло в групата на KD, не можем да изключим възможността ефектите за понижаване на Aβ да се дължат на CR.
И все пак CR и KD могат да работят чрез подобни механизми. KD са добре известни с това, че намаляват инсулиновата сигнализация и имитират глад, като по този начин увеличават окисляването на мастните киселини и насърчават катаболното състояние [17]. По подобен начин, CR е добре известно, че намалява серумните нива на инсулин и IGF и голяма част от ползата от CR може да произтича от това намаляване на сигнализирането за инсулин/IGF (за преглед вж. [25]). Например намалената инсулинова/IGF-подобна сигнализация инхибира протеиновия синтез и насърчава разграждането на протеините, което може да доведе до изчистване на чувствителните към разграждане протеини, като амилоидни пептиди.
Все повече доказателства предполагат роля на инсулина/IGF-1 в регулирането на APP и модулирането на нивата на Ар. Рецепторите както за инсулин, така и за IGF-1 са силно изразени в мозъка, особено в хипокампуса и кората, където те могат да повлияят на ученето и паметта [26]. Инсулиновата сигнализация в мозъка увеличава извънклетъчните нива на Ар чрез насърчаване на секрецията [27] и инхибиране на разграждането от ензима, разграждащ инсулина [28]. Тази гледна точка също спечели скорошна подкрепа при хората. Фишел и др. демонстрира, че индуцираната хиперинсулинемия при здрави пациенти в напреднала възраст повишава нивата на Ар както в серума, така и в гръбначния стълб, предполага, че инсулинът играе роля при повишаването на Ар, особено при условия като диабет тип II [29].
Подобна интерпретация е в съответствие с неотдавнашни проучвания, демонстриращи сходни Aβ понижаващи ефекти на режим с ниско съдържание на въглехидрати и калорични рестрикции (CR) при мишки, изразяващи "шведската" форма на APP (мишки Tg2576). При тези животни са открити по-ниски нива на Ар 40 и 42 при животни, хранени с 30% по-малко въглехидрати от ad libitum хранени животни. Ефектът на понижаване на Ар може да се дължи на повишената активност на ензима, разграждаща а-секретазата и инсулина, разграждащ CR животните [30].
Алтернативно, други физиологични промени може да са намалили нивата на Ар в това проучване. Високите нива на кетонни тела сами по себе си може да са допринесли за повишен белтъчен оборот. Доказано е, че кетонните тела, добавени към клетъчната култура, водят до повишено окисление на протеини, склонни към окислително увреждане. Наличието на увредени протеини предизвиква протеолиза на нормално дълголетни протеини чрез автофагия, медиирана от шаперон [31]. Такъв механизъм може да работи при животни, хранени с кетогенна чау и изложени на високи нива на кетонни тела. Известна подкрепа за този модел идва от наблюдението, че повишените кетонни телесни нива корелират по-добре с намаляването на видовете Aβ, отколкото загубата на тегло. В допълнение, кетонните тела могат да служат като ефективен субстрат за метаболизма на невроните. Предишни проучвания показват, че острото повишаване на кетонните тела може да подобри когнитивните показатели при някои индивиди с лека до умерена AD [32].
Заключение
С напредване на възрастта на населението в развития свят честотата на АД се очаква да нарасне драстично и ще постави огромна тежест върху здравните услуги [2]. Диетичната намеса представлява относително безопасен и леснодостъпен метод за борба с БА. И все пак ключовите диетични връзки остават неясни. Голяма част от по-ранната работа се фокусира върху ролята на диетите с високо съдържание на мазнини или висок холестерол и техния принос за AD. Доказателствата обаче сочат, че основният генетичен рисков фактор за късното начало на AD, алелът epsilon4 на аполипопротеин Е, може да е бил избран за популации с дълго историческо излагане на земеделието [33]. В допълнение, храните, богати на въглехидрати, са сравнително скорошни добавки към човешката диета и вероятно ще бъдат по-еволюционно несъответстващи от диетите с високо съдържание на мазнини [34]. Следователно неотдавнашният еволюционен преминаване към диети с високо съдържание на въглехидрати (HC) може да играе важна роля в развитието на AD. HC диетите са добре известни, че стимулират инсулиновата сигнализация и водят до потискане на липидния метаболизъм [22]. По този начин такива диети могат да доведат до неподходяща липидна среда в невроните, неправилно разцепване на APP и произтичащото от това инхибиране на клетъчния трафик и в крайна сметка увеличаване на риска от развитие на AD (за преглед вж. [35]).
Методи
Животни
Вземане и анализ на кръв
Кръв се взема от анестезирани мишки от орбиталния сплит или чрез сърдечна пункция. Нивата на β-хидроксибутират бяха измерени спектрофотометрично, използвайки β-хидроксибутират комплект Stanbio ликвиколор (Stanbio Inc., Boerne, Texas).
Тест за разпознаване на нов обект
- Анализ на експресионните спектри на piRNA в модел на мишка без алкохолна мастна чернодробна болест, индуциран от
- Ръководство за хранене на болестта на Алцхаймер за клиницисти
- Автоимунна палео диета (AIP) Лечебно хранене за хора с автоимунна болест
- 10 основни правила, които трябва да спазвате при кетогенната диета! BioKeto
- Диета за автоимунно заболяване