Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Медицински факултет на Дейвид Гефен, UCLA, Лос Анджелис, Калифорния, САЩ
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Медицински факултет на Дейвид Гефен, UCLA, Лос Анджелис, Калифорния, САЩ
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Катедра по медицина, Отдел по фармакология, Медицински факултет на Университета в Патра, Рио, Гърция
Резюме
Аполипопротеин Е е полиморфен гликопротеин при хора с молекулна маса 34,5 kDa. Той е компонент на остатъците от хиломикрон, липопротеини с много ниска плътност, липопротеини с ниска плътност и липопротеини с висока плътност и е отговорен главно за поддържането на плазмената липидна хомеостаза. В допълнение към тези добре документирани функции, последните проучвания в експериментални модели на мишки, както и популационни проучвания, показват, че аполипопротеин Е също играе важна роля в развитието на затлъстяване и инсулинова резистентност. Общоприето е, че нарушаването на хомеостазата между приема на храна и разхода на енергия и последващото отлагане на излишните мастни киселини в мастните клетки под формата на триглицериди, води до развитие на затлъстяване. Въпреки основната роля на затлъстяването и дислипидемията в развитието на метаболитния синдром и сърдечни заболявания, функционалните взаимодействия между мастната тъкан и компонентите на липопротеиновата транспортна система все още не са изследвани задълбочено. В този миниревю се фокусираме върху настоящата литература, свързана с участието на аполипопротеин Е в развитието на патологии, свързани с метаболитния синдром.
Съкращения
Въведение
Аполипопротеин Е (ApoE) е основен протеин на липидната и липопротеиновата транспортна система, участващ главно в метаболизма на хранителните липиди и отстраняването на атерогенни липопротеини, като остатъци от хиломикрон и липопротеини с много ниска плътност (VLDL), от циркулацията [[1, 2]]. При хората ApoE е полиморфен 34,5 kDa гликопротеин, синтезиран предимно от черния дроб, въпреки че се синтезира и от други тъкани, като мозъка и мастната тъкан. Човешкият ApoE има три естествени изоформи, ApoE2, ApoE3 и ApoE4 [[3]]. Тези изоформи се различават по своите аминокиселинни състави на позиции 112 и 158, където ApoE2 има Cys и на двете места, ApoE4 има Arg и на двете места, а ApoE3 има Cys112 и Arg158 [[3]]. Епидемиологичните проучвания свързват ApoE4 с повишени нива на LDL холестерол и повишен риск от развитие на сърдечно-съдови заболявания [[4, 5]].
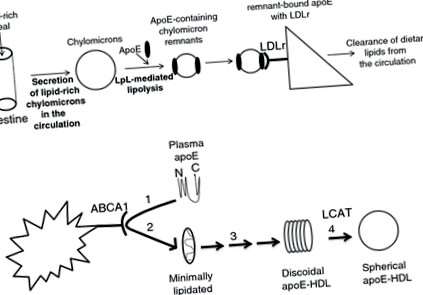
ApoE, свързан с липопротеини, е естественият лиганд за LDL-рецептора (LDLr) [[6, 7]], който е основният рецептор, участващ в клирънса на ApoE-съдържащите липопротеини in vivo [[8]]. След богато на липиди хранене, диетичните липиди се пакетират в хиломикрони, които след частична липолиза от липопротеинова липаза (LpL) се превръщат в остатъци от хиломикрон и придобиват ApoE [[2]] (Фиг. 1А). След това свързваният с липиди ApoE взаимодейства с LDLr, който медиира отстраняването на съдържащите ApoE атерогенни липопротеини от циркулацията (фиг. 1А). Мутациите в ApoE или LDLr, които предотвратяват физическите им взаимодействия, са свързани с високи нива на холестерол в плазмата и предразполагат към преждевременна атеросклероза при хора и опитни животни [[9, 10]].
(А) Обобщение на ролята на ApoE за изчистването на остатъците от хиломикрон и VLDL от циркулацията. Диетичните липиди се пакетират в хиломикрони, които след това се липолизират частично от плазмена липопротеинова липаза върху повърхността на съдовите ендотелни клетки. След липолиза хиломикроните придобиват ApoE и се превръщат в остатъци от хиломикрон. След това остатъците от хиломикрон, съдържащи ApoE, се поемат от черния дроб и други периферни тъкани главно чрез LDLr, който изглежда е основният физиологичен рецептор за остатъчен клирънс. (Б) Изобразяване на пътя на de novo биогенеза на ApoE-съдържащ HDL с участието на липидния транспортер ABCA1 и плазмения ензим LCAT. Минимално липидираният ApoE в плазмата взаимодейства с ABCA1 (стъпка 1), който присъства в черния дроб или други периферни тъкани. Това взаимодействие насърчава липидирането на ApoE (стъпка 2), която след това се превръща в дискоидална HDL-подобна частица чрез последователност от стъпки, които все още не са добре разбрани (стъпка 3). След това ApoE, съдържащи дискоидални HDL-подобни частици, се превръщат в сферичен HDL чрез действието на плазмения ензим LCAT (стъпка 4).
В допълнение, ApoE също така насърчава изтичането на холестерол [[11]] и de novo биогенеза на сферични ApoE-съдържащи липопротеини с висока плътност (HDL) -подобни частици с участието на липидния транспортер ATP свързваща касета A1 (ABCA1) и плазмения ензим лецитин: холестерол ацил трансфераза (LCAT) (фиг. 1B) [[12] ]. По този начин ApoE може също да допринесе за поддържането на хомеостазата на холестерола в плазмата и тъканите и защитата от атеросклероза [[13-20]] чрез механизми, които са независими от взаимодействията му с LDLr [[18]].
Общоприето е, че нарушаването на хомеостазата между приема на храна и разхода на енергия и последващото отлагане на излишните мастни киселини в мастните клетки под формата на триглицериди, води до развитие на затлъстяване [[21]]. Богатата на липиди диета и заседналият начин на живот, физическото бездействие и дисбалансът в калоричното натоварване са най-честите фактори за развитието на централното затлъстяване и метаболитния синдром [[22, 23]]. Стареенето, хормоналният дисбаланс и генетичното предразположение също могат да допринесат за затлъстяването [[24-35]].
Епидемиологичните и популационните проучвания установяват пряка връзка между затлъстяването и развитието на сърдечно-съдови заболявания [[36, 37]]. Въпреки основната роля на затлъстяването и дислипидемията в развитието на метаболитния синдром и сърдечно-съдови заболявания, функционалните взаимодействия между мастната тъкан и липидната и липопротеинова транспортна система започват да се изследват едва наскоро.
ApoE при диференциация на адипоцитите и липидно натоварване
Инвитро експерименти, използващи култури от първични преадипоцити, адипоцити, експланти на мастна тъкан или 3T3-L1 клетки, предоставят известна информация за ролята на ApoE в диференциацията на преадипоцитите и за експресията на ApoE от зрели адипоцити.
Изследване на Chiba и др. [[38]] предостави първите преки доказателства, че свързан с липидите ApoE насърчава диференциацията на преадипоцитите по зависим от дозата начин. Използвайки стромални клетки от костен мозък от ApoE-дефицитни (ApoE -/-) мишки и 3T3-L1 клетки, тези изследователи показват, че ApoE-дефицитният VLDL не успява да индуцира адипогенеза, докато нормалният VLDL насърчава диференциацията на тези клетки в мастните клетки. Инкубацията на ApoE-дефицитен VLDL с рекомбинантен човешки ApoE частично възстановява способността му да стимулира адипогенезата, докато селективното отстраняване на ApoE от VLDL чрез трипсин премахва адипогенната активност на човешката VLDL. Когато в тези експерименти се използва тетрахидролипстатин, мощен липопротеин липазен инхибитор, той не променя способността на съдържащият ApoE VLDL да стимулира адипогенезата, което предполага, че хидролизата на VLDL триглицеридите не играе основна роля в адипогенните ефекти на съдържащите ApoE VLDL. По същия начин отделни липидни компоненти на VLDL или свободни мастни киселини сами индуцират експресията на специфични за адипоцитите гени, но не успяват да генерират адипоцити, пълни с големи липидни капчици, и това откритие се интерпретира като частична адипогенеза в сравнение с ефектите на ApoE-съдържащи VLDL.
Интересното е, че друг набор от експерименти, проведени от Huang и др. [[41]] предполага, че експресията на ApoE в адипоцитите се влияе от състоянието на хранене на мишките, от които е получена тъканта. Експресията на ApoE се предизвиква на гладно, докато индуцираното от диетата затлъстяване или хиперфагия се свързва с намалената експресия на ApoE в мастната тъкан. Тъй като други проучвания показват, че ApoE-експресията в мастната тъкан насърчава натрупването на липиди и диференциацията на адипоцитите [[39]], една интерпретация на резултатите, получени от Huang и др. [[41]] е, че присъщите защитни механизми в мастната тъкан ограничават адипогенезата чрез намаляване на експресията на ApoE в хранено състояние. Със сигурност са необходими допълнителни проучвания, за да се определи ролята на синтезирания от адипоцитите ApoE и да се направи разлика между функциите на периферно експресирания ApoE спрямо експресирания на адипоцити ApoE.
Изследвания върху експериментални модели на мишки
Въпреки разликите в анатомията, патологията, физиологията и метаболизма между мишките и хората, проучванията върху мишки през последните няколко десетилетия осигуряват важни насоки по отношение на патогенезата и генетиката на човешките метаболитни заболявания, включително затлъстяването. Редица проучвания в експериментални модели на мишки осигуряват категорична връзка между ApoE и затлъстяването.
Работа от Чиба и др. [[38]] демонстрира, че лептин с дефицит (ob/ob) мишки, които също имат дефицит на апоЕ (ob/ob × ApoE -/-) не показват повишено телесно тегло или повишено количество мастна тъкан, когато се хранят с диета с високо съдържание на мазнини/висок холестерол, въпреки повишаването на плазмените нива на VLDL. За разлика от това, контрол ob/ob мишки, хранени с диета с високо съдържание на мазнини/висок холестерол за същия период от време, показват повишено телесно тегло и количество мастна тъкан, което предполага, че ApoE е ключов модулатор на адипогенезата in vivo.
В съгласие с това проучване, Хуанг и др. [[39]] съобщават, че ApoE -/- мишките имат по-малко съдържание на телесни мазнини и по-малки адипоцити в сравнение с контролите от див тип C57BL/6. Проучване на Хофман и др. [[42]] допълнително разшири това наблюдение, като показа, че ApoE -/- мишки, хранени с диабетогенна диета с високо съдържание на мазнини и захароза в продължение на 24 седмици, са били устойчиви на индуцирано от диетата затлъстяване и показват подобрен глюкозен толеранс и усвояване от мускулите и кафявата мастна тъкан тъкан, докато техните плазмени нива на инсулин са по-ниски в сравнение с контролните мишки от див тип C57BL/6. Намаленото телесно тегло и подобреният гликемичен контрол на ApoE -/- мишките бяха придружени от нарушен плазмен клирънс на триглицеридите и усвояване на липиди от мастната тъкан. Изследванията с директна калориметрия не разкриха значителни разлики в енергийните разходи и дихателния коефициент между ApoE -/- и мишки от див тип C57BL/6, хранени с високомаслена, високо захарозна диета в продължение на 24 седмици, което предполага, че при липса на ApoE, намаленото доставяне на плазмен липид към чувствителни към инсулин тъкани подобрява инсулиновата чувствителност и предотвратява развитието на диета, предизвикано от затлъстяване.
В медицинската общност имаше много дискусии относно ролята на възпалението при затлъстяването. По-специално, въпреки че някои изследвания предполагат, че възпалението причинява затлъстяване, други представят данни, подкрепящи идеята, че възпалението е просто метаболитен страничен ефект на затлъстяването. Отдавна е известно, че ApoE е противовъзпалителна молекула [[48]] и се счита, че дефицитът на ApoE предизвиква общо възпаление, което води до спонтанна атеросклероза при ApoE -/- мишки [[49]]. По този начин, устойчивостта на ApoE -/- мишките към развито индуцирано затлъстяване може да подкрепи теорията, че възпалението не предизвиква затлъстяване, а по-скоро е резултат от него.
Шен и др. [[56]] предполага, че експресията на апоЕ в мозъка намалява приема на храна при плъхове. По-конкретно, интрецеребровентрикуларното инжектиране на ApoE при плъхове намалява приема на храна, докато интрецеребровентрикуларната инфузия на ApoE антисерумно стимулирано хранене. Въпреки това, в предишни проучвания [[38, 43, 45, 55]], които сравняват ApoE-дефицитни с ApoE-експресиращи мишки, няма значителни промени в дневния прием на храна между тези групи мишки. Една от възможностите е, че периферните ефекти на ApoE, предразполагащи към затлъстяване в тези проучвания, компенсират специфичните за мозъка ефекти, които намаляват приема на храна в проучването на Shen и др. [[56]].
Експресия на ApoE и затлъстяване в епидемиологични проучвания
В допълнение към пряката си връзка с индекса на телесна маса и затлъстяването, ApoE4 фенотипът изглежда също е връзката между затлъстяването и аномалиите, свързани с метаболизма на глюкозата и диабета. При мъже със затлъстяване, експресията на апоЕ4 изоформата е корелирана с по-високи нива на инсулин и глюкоза в плазмата, отколкото при мъже със затлъстяване, експресиращи другите фенотипове на АпоЕ [[60, 61]]. Въпреки това, не се наблюдава такава връзка между ApoE фенотипа и нивата на инсулин или глюкоза при мъже без затлъстяване [[60]], докато връзката между ApoE4 фенотип и нивата на инсулин и глюкоза става по-силна с увеличаване на индекса на телесна маса [[60, 61] ]. Тези открития отново повдигат интересната възможност, че въпреки че хиперпластичните видове затлъстяване могат да бъдат по-екстремни при индивиди, изразяващи други ApoE-фенотипи, именно хипертрофичните адипоцити при лица, експресиращи ApoE4, могат да доведат до метаболитни дисфункции по отношение на отговорите на инсулина.
АпоЕ и затлъстяване
Отдавна е известно, че ApoE е атеропротективен, главно поради способността му да насърчава отстраняването на атерогенни липопротеини от циркулацията и образуването на ApoE-съдържащи HDL частици (фиг. 1). Въпреки това, последните данни за ApoE и затлъстяването (Таблица 1) показват, че ако излишните хранителни липиди присъстват в циркулацията, това атеропротективно свойство на ApoE може да бъде противодействано от засиленото отлагане на хранителни липиди в мастната тъкан (фиг. 2), което може да бъде резултат, поне отчасти, на присъствието на ApoE-разпознаващи рецептори на повърхността на адипоцитите. В обобщение, наскоро придобитите знания, съобщени в литературата, идентифицират експресията на ApoE като ключов периферен принос за развитието на затлъстяване и свързаните с него метаболитни дисфункции.
| Чиба и др. [[38]] | ApoE -/- × Ob/Ob срещу Ob/Ob | АпоЕ-дефицитът прави генетично предразположен лептин-дефицитен (ob/ob) мишки, устойчиви на индуцирано от диетата затлъстяване, главно защото ApoE-съдържащият VLDL насърчава адипогенезата |
| Хуанг и др. [[39]] Хофман и др. [[42]] | C57BL/6 срещу ApoE -/- | Мишките с дефицит на ApoE са по-слаби от своите аналози от див тип и устойчиви на индуцирано затлъстяване след 24 седмици хранене със западен тип диета |
| Гао и др. [[43]] | ApoE -/- × Ай/+ срещу Ай /+ | АпоЕ-дефицитът прави генетично предразположен Ай/+ мишки, устойчиви на затлъстяване главно чрез ограничаване на усвояването на VLDL от мастната тъкан |
| Карагианиди и др. [[45]] | ApoE3удар срещу C57Bl/6 срещу LDLr -/- срещу ApoE -/- | ApoE насърчава затлъстяването, предизвикано от диетата и инсулиновата резистентност, поне отчасти, чрез взаимодействието си с LDLr, след 24 седмици хранене със западен тип диета. Човешкият ApoE3 е по-мощен от ApoE при мишки при насърчаването на затлъстяването, предизвикано от диета |
| Хофман и др. [[50]] | Специфична за мастната тъкан LRP1 -/- срещу мишки от див тип | Специфичното за мастната тъкан делеция на LRP1 прави мишките устойчиви на индуцирано от диетата затлъстяване чрез ограничаване на постпрандиалния липиден клирънс |
| Гурдиан и др. [[51]] | VLDLr -/- срещу мишки от див тип | Делецията на VLDLr прави мишките устойчиви на индуцирано от диетата затлъстяване, вероятно чрез ограничаване на LpL-медиирана липолиза на постпрандиални триглицериди |
| Arbones ‐ Mainar и др. [[55]] | ApoE3knock-in срещу ApoE4knock-в мишки | Мишките, експресиращи ApoE3, изглежда са по-чувствителни към индуцирано затлъстяване, но по-малко склонни към инсулинова резистентност, отколкото мишки, експресиращи ApoE4, след 8 седмици хранене със западен тип диета |
Модел за ролята на ApoE в развитието на индуцирано от диетата затлъстяване при мишки. Диетичните липиди се пакетират в хиломикрони в червата и след това се секретират в циркулацията (стъпка 1), където те частично се липолизират от плазмена липопротеинова липаза и придобиват ApoE (стъпка 2). След това остатъците от хиломикрон, съдържащи ApoE, взаимодействат с рецептори, като LDLr, LRP1 и VLDLr, присъстващи на повърхността на редица клетки, включително хепатоцити и адипоцити (стъпка 3). Това взаимодействие насърчава доставката на диетични липиди до мастната тъкан и води до затлъстяване, предизвикано от диетата и свързани метаболитни дисфункции (стъпка 4). При липса на експресия на ApoE или разпознаващи ApoE рецептори, доставката на хранителни липиди до мастната тъкан се блокира (стъпки 3 и 4), което води до резистентност към индуцирано от диетата затлъстяване.
Благодарности
Тази работа беше подкрепена от Седмата рамкова програма на Европейската общност [FP7/2007‐2013] споразумение за предоставяне на безвъзмездни средства PIRG02-GA-2007‐219129 и грант за научни изследвания на Университета в Патрас Каратеодорис, и двете предоставени на K. E. Kypreos. Бихме искали да благодарим на нашия статистик г-н E. E. Kypreos за неговото съдействие при подготовката на ръкописа.
- Затлъстяване, диабет и стомашно-чревно злокачествено заболяване Ролята на метформин и други антидиабетни средства
- Затлъстяване, свързано със затлъстяването заболяване и увреждане
- Механизми, чрез които затлъстяването въздейства върху астма Торакс
- Механизми на акупунктурна терапия за просто затлъстяване Преглед на клинични и
- Затлъстяване; s Роля при артрит и болки в ставите - Център за тегло - Ежедневно здраве