Център за биомедицински изследвания в Пенингтън, Държавен университет в Луизиана, Батон Руж 70808;
Университет на Джорджия, Атина, Грузия 30602
Център за биомедицински изследвания в Пенингтън, Държавен университет в Луизиана, Батон Руж 70808;
Център за биомедицински изследвания в Пенингтън, Държавен университет в Луизиана, Батон Руж 70808;
Катедра по физиология, Медицински факултет на държавния университет на Луизиана, Ню Орлиънс, Луизиана 70112; и
Резюме
затлъстелият протеин лептин, произведен главно от мастна тъкан и освободен в кръвта, е важен хормон за контрол на приема на храна и хомеостазата на телесното тегло (5, 6, 16, 29). Синтезът на този хормон in vitro изглежда реагира както на инсулин, така и на глюкокортикоиди (4, 23, 24). Лептинът се транспортира в мозъка чрез наситена система (3), където действията му се модулират чрез дългата форма (OB-Rb) на рецептора и активирането на JAK-STAT сигнален път (15). Нарушенията на лептиновия път водят до развитие на затлъстяване. Лептинът намалява приема на храна и увеличава енергийните разходи и в дветеob/ob и нонобез мишки (5, 17).
Животни и диета.
В тези експерименти бяха използвани петдесет мъжки плъхове Osborne-Mendel от размножителната колония в Биомедицинския център Pennington, с начално тегло 250 ± 2 g. Плъховете бяха настанени в окачени клетки от неръждаема стомана в контролирана от температурата стая (22–23 ° C) с 12: 12-часов цикъл светлина-тъмнина (светлините са включени в 0700) и свободен достъп до автоматична система за поливане. Те са адаптирани или към диета с високо съдържание на мазнини (56% от енергията от мазнини, 4,78 kcal/g) или към диета с ниско съдържание на мазнини (10% енергия от мазнини, 3,66 kcal/g) в продължение на минимум 2 седмици. Съдържанието на протеини и при двете диети е идентично при 24% от общата енергия. Съставът на тези диети е описан по-рано (19). Чашите за храна бяха закрепени в клетките с пружини от неръждаема стомана и ежедневно се осигуряваше прясна диета. Експерименталните процедури и протоколи бяха одобрени от Институционалния комитет за грижи и употреба на животните.
Пептид.
Рекомбинантният миши лептин е подарък от Novartis (Базел, Швейцария), както е описано другаде (22). Лептинът се разтваря във физиологичен разтвор (0,9% тегл./Об.) И се прилага като болусна инжекция на всеки ден за изпитване в доза 0,5 mg/kg телесно тегло интраперитонеално.
Проучване на храненето.
Серумни анализи.
Използвани са търговски радиоимуноанализи за анализ на серумен лептин и инсулин (Linco, St. Charles, MO) и кортикостерон (ICN Pharmaceuticals, Коста Меса, Калифорния).
Изолиране на обща РНК.
Общата РНК беше извлечена от хипоталамусната тъкан чрез модифицирания метод на гуанидиний-изотиоцианат (8) с използване на TRIzol Reagent (GIBCO), съгласно инструкциите на производителя.
cDNA сонди и Northern blots.
ДНК на 377 bp NPY плазмид е подарък от д-р Y. J. Zhou (Pennington Center), а плазмидната ДНК на 5-HT2C рецептора е любезно предоставена от д-р D. J. Julius (18). Β-актинът DecaProbe е получен от Ambion (Austin, TX). Двадесет микрограма обща хипоталамусна РНК бяха денатурирани при 65 ° С в продължение на 15 минути, електрофорезирани върху 10 g/l агарозни/формалдеидни гелове и прехвърлени в найлонови мембрани (Zeta-Probe, Bio-Rad Laboratories, Hercules, CA). NPY и 5-HT2C рецепторните сонди бяха маркирани с използването на комплект DECA prime II (Ambion) с [32 P] dCTP, 3 Ci/mol (111 GBq/mol) (NEN, Бостън, Масачузетс). Петната бяха предварително хибридизирани с 500 g/l формамид, 0.12 mol/l Na2HPO4 2− (pH 7.2), 0.25 mol/l NaCl и 70 g/l SDS за 1 h при 42 ° C. Хибридизацията беше извършена в продължение на 18 часа при 42 ° С в същия буфер, съдържащ 1 × 10 9 броя · мин -1 -1 μg -1 от 32 Р-маркирана сонда. След това мембраните се измиват при стайна температура с 2 × натриев хлорид-натриев цитрат (SSC)/9 g/l SDS за 15 минути, 0.5 × SSC/(g × SDS) за 20 минути и 0.1 × SSC/(g × l SDS) за 15 минути при 65 ° С. Мембраните бяха изложени на екрана на PhosphorImager за една нощ, след това се отстраниха и рехибридизираха с β-актин cDNA сонда като контрола за зареждане и прехвърляне на гел. Интензивността на сигнала беше анализирана на PhosphoImage (Molecular Dynamics).
Анализ на данни.
Всички резултати са представени като средни стойности ± SE. Данните бяха анализирани от ANOVA и пост hoc тестовете бяха направени с помощта на теста на Дънкан с множество обхвати.
Тествани диети същите като адаптирани диети.
Ефектите от периферното инжектиране на лептин върху приема на храна от плъхове, адаптирани към диетата с високо съдържание на мазнини или ниско съдържание на мазнини и тествани върху техните обичайни диети, са показани на фиг. 1. Лечението с лептин (0,5 mg/kg ip) намалява приема на храна в плъхове, хранещи се с нискомаслена диета (лечение: F1,8 = 13,07,P 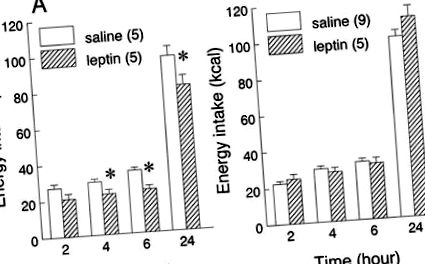
Фиг. 1.Ефектите от приложението на периферен лептин върху приема на ниско съдържание на мазнини (LF; A) или диета с високо съдържание на мазнини (СН);Б.). Плъховете са тествани на същата диета, към която са адаптирани. Дозата на лептин е 0,5 mg/kg телесно тегло ip. Данните са представени като средни стойности ± SE от кумулативния прием (kcal) от всяка диета. Броят на животните във всяка група е показан в скоби. *P
Плъхове, адаптирани към диети с високо съдържание на мазнини, тествани с диета с ниско съдържание на мазнини.
Когато плъховете, адаптирани преди това към диетата с високо съдържание на мазнини, наивно са получили диета с ниско съдържание на мазнини веднага след прилагане на лептин (фиг. 2)A), лептинът значително намали приема на диета с ниско съдържание на мазнини (F1,13 = 4,69, P
Фиг. 2.Ефектът на лептина при плъхове, адаптиран към високочестотна диета, но тестван и след това поддържан върху НЧ диета. На ден 1, плъховете са били наивни към LF диетата. Данните са представени като средни стойности ± SE от кумулативния прием (kcal). Броят на животните във всяка група е показан в скоби. *P
Плъхове, адаптирани към диета с ниско съдържание на мазнини, тествани с диета с високо съдържание на мазнини.
Когато плъховете, адаптирани към диетата с ниско съдържание на мазнини, бяха наивно представени с диета с високо съдържание на мазнини (фиг. 3), лептинът значително потиска приема на храна през всички точки от 2 до 24 часа (лечение с лептин: F1,9 = 23,46,P
Фиг. 3.Ефектът на лептина при плъхове, адаптиран към LF диетата, но тестван и след това поддържан върху HF диетата. На ден 1, плъховете са били наивни към СН диетата. Данните са представени като средни стойности ± SE от кумулативния прием (kcal). Броят на животните във всяка група е показан в скоби. *P
Концентрация на серумен хормон.
Ефектите на лептина и диетата върху циркулиращите нива на лептин, кортикостерон и инсулин при плъхове, хранени с либит, поддържани в продължение на 20 дни върху диети с високо съдържание на мазнини или ниско съдържание на мазнини, са показани на фиг. Плъховете, поддържани на диета с високо съдържание на мазнини, са имали значително по-високо телесно тегло (високо съдържание на мазнини: 483 ± 13,1 g спрямо ниско съдържание на мазнини: 437 ± 6,3 g) и ниво на серумен лептин (фиг. 4)A) в края на изследването. След инжектиране на лептин серумният лептин се повишава до същите нива и в двете групи плъхове, независимо от диетата им (лептин/високо съдържание на мазнини: 30,7 ± 3,3 ng/ml; лептин/ниско съдържание на мазнини: 31,9 ± 10,2 ng/ml). Статистическият анализ също показва значителни ефекти върху диетата върху инсулина (диета: F1,26 = 9,26, P
Фиг. 4.Концентрациите на серумни хормони при плъхове преминават към СН или НЧ диета в продължение на 20 дни и се лекуват остро с лептин или физиологичен разтвор. Стойностите (ng/ml) представляват средните стойности ± SE за 6-8 плъхове във всяка група. a, b, And c показват значителна разлика катоP
Хипоталамусна NPY иРНК и експресия на 5-HT2C рецептор.
Както е показано на фиг. 5, плъхове, хранени с диета с ниско съдържание на мазнини, са имали по-високи нива на иРНК на хипоталамус NPY, отколкото плъхове, хранени с диета с високо съдържание на мазнини (диета: F1,25 = 13,19,P
Фиг. 5.Ефект на лептина върху експресията на иРНК на хипоталамусен невропептид Y (NPY) на плъхове, хранени с HF или LF диета. A: Северно петно на NPY mRNA и β-актин mRNA от всяко отделно животно. Б.: съотношение на NPY и β-актин иРНК. Стойностите представляват средните стойности ± SE за 6-8 плъхове във всяка група. a, b, And c показват значителна разлика като P
Фиг. 6.Ефектът на лептина върху експресията на иРНК на рецептор на хипоталамус 5-хидрокситриптамин (5-НТ2С) на плъхове, хранени с HF или LF диета. A: Северно петно на 5-HT2C рецепторна иРНК и β-актин иРНК от всяко отделно животно. Б.: съотношение на 5-HT2C рецепторна иРНК и β-актин иРНК. Стойностите представляват средни стойности ± SE за 6-8 плъхове във всяка група. a И b показват значителна разлика като P
Основната констатация на това проучване е, че реакцията на хранене към периферния лептин се влияе от състава на диетата, който се наблюдава, когато плъховете се хранят с диета с ниско съдържание на мазнини, но не и при плъхове, консумиращи диета с високо съдържание на мазнини. Когато плъхове с ниско съдържание на мазнини са били тествани с диета с високо съдържание на мазнини, е налице хипофагичният ефект на лептина върху диетата с високо съдържание на мазниниден 1, но изчезна от дни 5 и15. За разлика от това, когато плъхове с високо съдържание на мазнини са били тествани с диета с ниско съдържание на мазнини, намаляването на храненето е очевидно дни 1и 15. Тези данни предполагат, че поглъщането на диета с високо съдържание на мазнини премахва отговора към периферния лептин и че хранителните мазнини могат да предизвикат „лептинова резистентност“ за кратък период от време. В допълнение, лептинът намалява хипоталамусната NPY иРНК при плъхове с ниско съдържание на мазнини, но не и при плъхове, поддържани на диета с високо съдържание на мазнини.
Редица фактори могат да допринесат за развитието на лептинова резистентност след въвеждане на диета с високо съдържание на мазнини. Те включват присъствието на циркулиращ антагонист или свързващ протеин, промени в клирънса, транспортиране в мозъка, понижаване на рецептора на лептин, инхибиране на JAK-STAT пътя или активиране на SOCS3 или други инхибитори на цитокиновия сигнал (15). Изглежда възможно диетата с високо съдържание на мазнини да повиши клирънса на лептин, тъй като нарастването на циркулиращите нива на лептин, постигнато след интраперитонеално инжектиране на лептин, е било по-малко при плъхове, хранени с високо съдържание на мазнини, в сравнение с диета с ниско съдържание на мазнини. Транспортът на лептин в мозъка е наситен (3) и може да бъде повлиян от хранителните мазнини, както се предполага от наблюденията на Banks et al. (2). Възможно е също така регулирането на рецептора или десенсибилизацията на рецептора да повлияе на сигналния път. Наскоро показахме, че повишаването на чувствителността към лептин след адреналектомия се дължи както на конститутивно активиране на пътя JAK-STAT, така и на инхибиране на експресията на инхибиторния ген SOCS3 (28).
Перспективи
Диетите с високо съдържание на мазнини се превърнаха в популярна диета, чрез която затлъстяването може да бъде предизвикано при модели на гризачи. Както при другите форми на затлъстяване, това е свързано с увеличаване на секрецията на лептин. Предполага се, че очевидното развитие на лептинова резистентност е свързано с бързото отлагане на излишните телесни мазнини и развиващото се затлъстяване. Настоящите експерименти предполагат, че диетата с високо съдържание на мазнини предизвиква състояние на резистентност към периферния лептин. Подобни промени в реакцията на други орексигенни и аноректични агенти, например CCK и ентеростатин, също са наблюдавани при промени в състава на диетата. С ентеростатин отново промените в отговор на диетата се появиха много бързо или изчезнаха. Такива проучвания предполагат, че сигнал, свързан с поглъщането на мазнини, модулира отговора на редица пептиди и метаболитни сигнали, който влияе върху поглъщащото поведение. Идентичността на „мастния сигнал“ е неясна. Това може да бъде или пряк отговор на компонент от диетата; обонятелна, вкусова, сензорна или стомашно-чревна нервна реакция; или може да има ендокринен характер. Идентифицирането на този сигнал ще даде значителен поглед върху нашето разбиране за контрол на телесното тегло.
Тази работа беше подкрепена от Национален институт по диабет и храносмилателни и бъбречни заболявания. 45278 и грант № на Националния институт за детско здраве и човешко развитие. 28997.
СТЪПКИ
Адрес за заявки за препечатка и друга кореспонденция: L. Lin, Pennington Biomedical Research Center, 6400 Perkins Road, Baton Rouge, LA 70808 (E-mail: [email protected] edu).
- 8 промени в диетата, за да живеете по-дълго с диетата за дълголетие
- Американски ресторант Диета Ръководство The Leaf Nutrisystem Blog
- Диета на Ейми Адамс; Фитнес; Американски шум; План за детоксикация План за почистване
- Отговор на бройлери на енергия или разреждане на енергия и протеини в диетата на финишъра - ScienceDirect
- 5 вкусни диетични промени, които направих за красива, блестяща кожа; Красива с мозъци
