Резюме
Въведение
Възпалителните заболявания на червата (IBD), включително болестта на Crohn (CD) и улцерозен колит (UC), са хронични, рецидивиращи, чревни възпалителни състояния със сложна и все още неразкрита патогенеза, при която генетични, имунологични и екологични фактори играят роля (Sobczak et al . 2014 г.). Възпалението при CD обхваща цялата чревна стена и може да се появи във всяка част на стомашно-чревния тракт (GI), докато при UC е засегната само лигавицата на дебелото черво (Zatorski et al. 2015). И двете заболявания са свързани с промени в вродената и адаптивна имунна система, микробиота и епителна функция (Zietek et al. 2017; Siczek et al. 2017). По този начин, неподходящият отговор на различни патогени в епителната повърхност може да причини освобождаване на възпалителни цитокини и да предизвика възпаление.
Честотата и разпространението на IBD са най-високите в западните страни, което предполага нарастващата роля на факторите на околната среда (Molodecky et al. 2012). Важно е, че докато честотата на IBD все още нараства, смъртността е ниска и по този начин разпространението на IBD ескалира в световен мащаб (Molodecky et al. 2012). В днешно време се регистрира по-голям дял от пациенти в напреднала възраст с IBD със съпътстващи заболявания, като сърдечно-съдови заболявания и/или диабет (Román and Muñoz 2011); тези пациенти се нуждаят от по-сложно лечение и се превърнаха в голямо предизвикателство за гастроентеролозите. Освен това, неотдавнашни проучвания показват, че 15–40% от пациентите с IBD страдат от затлъстяване, което се превръща във все по-голям проблем при лечението на IBD. Доказано е също така, че пациентите със затлъстяване с IBD имат по-кратко време до първата операция, както и по-ниско качество на живот в сравнение с страдащите от IBD със затлъстяване (Singh et al. 2017).
В момента 5-аминосалицилати, имуносупресивни средства, кортикостероиди и биологични терапевтици се използват широко в терапията на IBD. Някои пациенти обаче не реагират на лечението. Освен това страничните ефекти и икономическите разходи от лечението на пациенти с IBD не могат да бъдат пренебрегнати (Stallmach et al. 2010; van der Valk et al. 2016). Тези факти, заедно с нарастващите съпътстващи заболявания при пациенти с IBD, показват, че са необходими спешни, по-сложни, нови терапевтични стратегии при лечението.
Този преглед представя данни за множеството ефекти на GLP при възпалителни чревни заболявания. Той обобщава настоящите познания за GLP, които имат потенциал да се превърнат в нова терапевтична опция в терапията на IBD.
Глюкагоноподобни пептиди
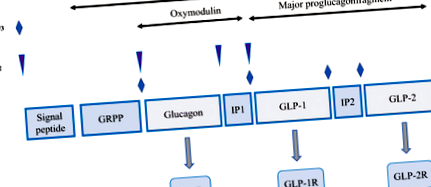
Производство на GLP при хора от gcg ген. IP1, инвертиращ пептид 1; IP2, инвертиращ пептид 2; GcgR, глюкагонов рецептор; GLP-1, глюкагоноподобен пептид 1; GLP-2. глюкагоноподобен пептид 2; GLP-1R. глюкагоноподобен пептиден 1 рецептор; GLP-2R, глюкагоноподобен пептиден 2 рецептор; GRPP. панкреатичен полипептид, свързан с глицентин, PC 1/3, прохормон конвертаза 1/3
GLP-1, когато се секретира от L клетки, може да действа в ендокринната (освобождавайки се в кръвния поток) или паракринния начин, т.е. стимулирайки невроните. GLP-1 упражнява анорексигенен ефект, като медиира сигнали от червата към мозъка чрез вагусни нерви (Gallwitz 2012). Освен това, GLP-1 има защитен ефект върху увреждането на невроните, както е показано чрез намаляване на индуцираното от иботенова киселина изчерпване на имунореактивността на холин ацетилтрансферазата (Perry 2002). В допълнение, мишките, които нямат GLP-1 рецептор, показват увреждане на когнитивната функция, синаптична пластичност и формиране на памет (Duan et al. 2017). Представените данни показват, че GLP-1 притежава плейотропни функции при множество заболявания. Към днешна дата екзенатид, лираглутид, албиглутид, ликсисенатид и дулаглутид, които са структурно модифицирани аналози на GLP-1 с удължен полуживот in vivo, се използват в клинични условия (Gupta et al. 2017).
GLP-2 е 33-аминокиселинен пептид, получен от проглукагон, който се експресира в тънките черва, главно в терминален илеум. Освен това, експресия на GLP-2 може да се наблюдава в дебелото черво, макар и в по-малка степен, отколкото в крайния илеум (Yusta et al. 2017). В дебелото черво плътността на GLP-2-имунореактивните клетки се увеличава от проксимална до дистална част с максимален брой GLP-2-положителни клетки в ректума (Litvak et al. 1998; Caddy et al. 2001; Schmidt et al. 2005). GLP-2 (1–33) е активна форма на GLP-2, която се освобождава в отговор на хранителна, хормонална и невронна стимулация. Последните данни показват, че диетичните фибри и късоверижните мастни киселини (SCFA), въглехидратите и мазнините са мощни стимулатори на секрецията на GLP-2. GLP-2 (3–33), биологично неактивна форма на GLP-2, която е продукт на разграждане на N-края на GLP-2 (1–33) от DPP-IV, може да действа като слаб частичен агонист на GLP-2 рецептора в механизъм за отрицателна обратна връзка.
GLP-2 действа чрез G протеин-свързан рецептор GLP-2R. Текущи изследвания показват, че стимулацията чрез сигнализиране на GLP-2/GLP-2R включва активиране на аденилил циклаза, повишено натрупване на cAMP и PKA и в крайна сметка ELK-1/c-fos/c-jun генно активиране. Освен това данните показват, че са включени MAP, EGFR/TyrK пътища (Martin et al. 2006). Известен е също като GI растежен фактор: увеличава чревния кръвен поток (Mayo et al. 2017), увеличава абсорбцията (Feng et al. 2017), пролиферацията, намалява апоптозата (Li et al. 2016) и намалява чревната пропускливост (Zhang и др. 2018) и потиска стомашната секреция и моториката. Последните данни демонстрират, че екзогенното приложение на GLP-2 корелира с увеличаване на общото тегло на червата, дължината, височината на вилусите, дълбочината на криптата и пролиферацията на криптни клетки (Gu et al. 2018). GLP-2 и неговите аналози се оказаха ефективни при лечението на синдром на късото черво при деца и възрастни, както се демонстрира чрез увеличаване на абсорбцията на хранителни вещества, намаляване на нуждите за парентерално хранене и подобрени Z резултати при педиатричната популация (Sigalet 2018).
DPP-IV, основен ензим, отговорен за разграждането на GLP
DPP-IV е отговорен и за регулирането на възпаление на мастната тъкан, медиирано от макрофаги/дендрични клетки (Zhong et al. 2013). В допълнение, при не-затлъстели мишки с диабет, DPP-IV инхибиторите значително увеличават Treg разширяването и нивото на TGF-β. DPP-IV активността е значително увеличена при затлъстели лица и при животински модели на затлъстяване (Yang et al. 2007; Lee et al. 2013).
Освен това инхибирането на DPP-IV предотвратява възпалението и медиира невропротективен ефект при две основни усложнения на захарния диабет, а именно исхемичен инсулт и увреждане на ретината. Този ефект се дължи на антиоксидантните свойства на DPP-IV, потискане на NF-κB, IL-6, TNF-α и повишаване на IL-10 (Gonçalves et al. 2014; El-Sahar et al. 2015).
Роля на GLP-1 в възпалителната регулация при IBD
Към днешна дата изследователите са се фокусирали главно върху антидиабетните и антиатеросклеротичните ефекти на GLP-1 агонистите, докато GI ефектите остават слабо разбрани. Независимо от това, проучване на Jensen et al. (2018) показват, че пациентите след колектомия показват повишен риск от диабет тип 2 в сравнение с пациенти без колектомия (HR 1,40; 95% доверителен интервал Cl 1,21 до 1,62). В друго проучване Palnaes et al. показа, че освобождаването на GLP-1 в отговор на приема на глюкоза е по-бавно при пациенти с UC, които са били подложени на колектомия (Palnaes Hansen et al. 1997). Освен това, постпрандиалният GLP-1 отговор също е бил нарушен при пациенти с илеостомия (Robertson et al. 1999). Тези данни разкриват връзката между GLP-1 и дебелото черво; все още не е известно дали възпалението засяга и освобождаването на GLP-1 при IBD. Интересното е, че последващите проучвания показват, че GLP-1R иРНК е намалена в проби, получени от възпалена област на дебелото черво при пациенти с IBD (Bang-Berthelsen et al. 2016). За разлика от това, GLP-1 е регулиран в серума на пациентите с IBD в сравнение с контролите (Keller et al. 2009, 2015). Тези данни ясно показват, че експресията на GLP-1 може да бъде свързана с възпаление при IBD.
Роля на GLP-2 в възпалителната регулация при IBD
Xiao et al. съобщава, че пациентите с UC и CD с активно заболяване имат повишени нива на биоактивен GLP-2 в сравнение със здрави индивиди (Xiao et al. 2000). За разлика от това, проучване, проведено от Schmidt et al. не демонстрира разлика в плазмената или тъканната концентрация на стимулиран с хранене GLP-2 между пациенти с IBD и не-IBD контроли (Schmidt et al. 2005). Тедуглутид в три различни дози, 0,05, 0,1 и 0,2 mg/kg дневно, е изследван в проспективно плацебо-контролирано проучване при 100 хора при лечение на умерен до тежък CD в 8-седмично проучване. Доказано е, че ремисия е индуцирана при над 55% от участниците в проучването при най-високата доза, в сравнение с само 33% от тези, получаващи плацебо след 8 седмици, въпреки че проучването не успява да достигне статистическа значимост спрямо плацебо (Buchman et al. 2010). Доколкото ни е известно, не са провеждани други клинични проучвания с пациенти с IBD.
Инхибиране на DPP-IV като потенциална терапевтична стратегия при IBD
От друга страна, DPP-IV е отговорен за разграждането на множество сигнални молекули като ендогенни опиоидни пептиди, включително ендорфини, динорфини и енкефалини, които играят решаваща роля в основните функции на стомашно-чревния тракт (напр. Подвижност, сигнализация за болка и секреция) ) (Sałaga et al. 2013). По този начин не може да се изключи, че при някои пациенти с IBD може да се наблюдава нарушаване на хомеостазата на стомашно-чревния тракт, което води до развитие или обостряне на IBD. По този начин има неудовлетворена необходимост от изследване на механизма на действие на инхибиторите на DPP-IV в стомашно-чревния тракт, както и дългосрочно постмаркетингово наблюдение на тези лекарства, за да се оцени тяхната безопасност.
Бъдещи перспективи
Заключения
GLP като нови терапевтични възможности при IBD - потенциални механизми на действие
- Ролята на диетата при възпалителни заболявания на червата - FullText - Annals of Nutrition and Metabolism 2016, Vol.
- Обогатената с пеларгонидин 3-глюкозид ягода отслабва симптомите на DSS-индуцирано възпалително черво
- Роля на периодичното гладуване за подобряване на здравето и намаляване на болестите
- Препоръка на диети на растителна основа при възпалителни заболявания на червата - Chiba - Translational
- Роля на екологичните химикали при затлъстяването Систематичен преглед на настоящите доказателства