Гуадалупе Наваро
2 Отдел по ендокринология и метаболизъм, Катедра по медицина, Станфордски университет, Станфорд, Калифорния 94305-5165, САЩ
Камил Алард
1 Секция по ендокринология и метаболизъм, Център за здравни науки на Университета Тулейн, Медицинско училище, Ню Орлиънс, LA 70112, САЩ
Weiwei Xu
1 Секция по ендокринология и метаболизъм, Център за здравни науки на Университета Тулейн, Медицинско училище, Ню Орлиънс, LA 70112, САЩ
Франк Мове-Джарвис
1 Секция по ендокринология и метаболизъм, Център за здравни науки на Университета Тулейн, Медицинско училище, Ню Орлиънс, LA 70112, САЩ
Резюме
Цели
При мъжете лишаването от андроген допринася за развитието на метаболитен синдром и диабет тип 2 (T2D). При жените излишъкът на андроген предразполага към инсулинова резистентност и T2D. Налице е двупосочна модулация на глюкозната хомеостаза от андроген при мъже и жени, която анализираме в този преглед.
Методи
Преглеждаме литературата както при гризачи, така и при хора за ролята на андрогените и андрогенните рецептори (AR) в контрола на глюкозния и енергийния метаболизъм в здравето, затлъстяването и T2D.
Резултати
Специфичното за пола активиране на AR в хипоталамуса, скелетните мускули, черния дроб, мастната тъкан и панкреасните островни бета-клетки отчита поддържането или нарушаването на енергийния метаболизъм и глюкозната хомеостаза.
Заключение
Ние твърдим, че AR е цел за предотвратяване на свързани с андрогена метаболитни нарушения.
Въведение
В този доклад ние правим преглед на литературата както при гризачи, така и при хора за ролята на тестостерона и андрогенния рецептор (AR) в контрола на холеостазата глюкоза/енергия и развитието на метаболитна дисфункция при мъжете и жените със специален акцент върху тъканните селективни действия в скелетните мускули, мастната тъкан, β-клетките на панкреаса на черния дроб и централната нервна система.
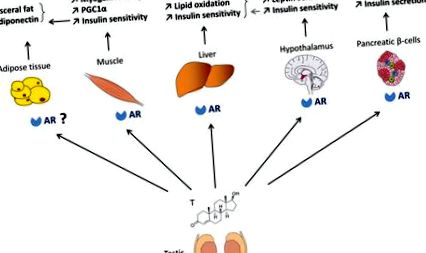
Роля на AR в хомеостазата на глюкозата при мъжете (Фигура 1)
При мъжете андрогените насърчават глюкозната и енергийна хомеостаза чрез действия върху AR в скелетните мускули, черния дроб, панкреасните бета-клетки и метаболитните центрове в хипоталамуса. Действията на андрогена върху мастната тъкан могат да бъдат косвено медиирани чрез AR действия в мускулите.
Дефицитът на тестостерон предразполага към T2D при мъжете
Има двупосочно взаимодействие между андрогена и диабета при мъжете, при което ниският тестостерон предразполага към диабет, а хипергликемията води до хипогонадизъм (7). Съществуват сериозни доказателства, че ниският тестостерон е свързан с и предсказва диабет при мъжете. В мета-анализ на 28 напречни сечения и проспективни проучвания, Ding et al установяват, че общите нива на тестостерон винаги са били по-ниски при мъжете с диабет, отколкото при недиабетните контроли, и че по-високите нива на тестостерон са свързани с по-нисък риск от инцидентен диабет 8). По-скорошен мета-анализ на проспективни и напречни изследвания също установи, че T2D е независимо свързан с ниски нива на общия тестостерон при мъжете (7). В допълнение, същият мета-анализ на метаболитния ефект на заместителната терапия с тестостерон установява, че терапията с тестостерон е свързана със значително намаляване на плазмената глюкоза на гладно, HBA1c, мастната маса и триглицеридите при мъжете (7). Въпреки че връзката между ниския тестостерон и затлъстяването е ясна, мъжете с диабет все още имат по-ниски нива на тестостерон дори след корекция за ИТМ (7, 9).
Много ниски нива на тестостерон по време на андрогенна терапия за лишаване от рак на простатата са свързани с повишен риск от диабет в няколко големи проучвания (10, 11). Наскоро наблюдателно проучване от ветераните на здравното управление показа, че сред пациентите с рак на простатата, андрогенната депривация терапия с GnRH агонисти е свързана с повишен риск от T2D (12). Друго проучване показва изразена хипергликемия и намалена функция на бета-клетките на панкреаса сред пациенти с рак на простатата след терапия с лишаване от андроген (13). По-специално, дефицитът на тестостерон също е свързан с нарушена глюкоза на гладно и непоносимост към глюкоза, независимо от затлъстяването и метаболитния синдром при мъжете (14). Като цяло тези проучвания показват, че ниският тестостерон предразполага към диабет при мъжете.
Андрогените предотвратяват натрупването на висцерални мазнини и подобряват чувствителността към инсулин
Тестостероновото действие в скелетните мускули насърчава инсулиновата чувствителност при мъжете
Андрогенните действия в черния дроб благоприятстват липидната хомеостаза и инсулиновата чувствителност
Централните андрогенни действия регулират енергийната хомеостаза при мъжете
AR се изразява по-обилно в мозъка на мъжки гризачи, отколкото на женските (41). Мъжки мишки с дефицит на цялото тяло с AR развиват затлъстяване без увеличаване на енергийния прием, но с намалена локомоторна активност. Тези мишки също показват намалена термогенеза на кафява мастна тъкан, което намалява енергийните разходи (24). AR също функционира в мъжкия хипоталамус, за да благоприятства централното действие на лептина. В действителност, при AR-дефицитни мъжки мишки лептинът не успява да насърчи STAT3 ядрената локализация в невроните на дъгообразните ядра (ARC) и не потиска приема на храна или намалява телесното тегло дори преди появата на явно затлъстяване (41). Освен това, специфичните за невроните ARKO (NARKO) мишки развиват затлъстяване, инсулинова резистентност и непоносимост към глюкоза. Тези мишки показват хипоталамусна инсулинова резистентност чрез активиране на хипоталамусния NFκB, който увеличава възпалението (42). Заедно тези наблюдения показват, че при мъжки гризачи AR участва в контрола на мастната тъкан чрез централни и периферни ефекти.
Андрогенно действие в β-клетките при мъжете
Ранните проучвания съобщават, че когато β-клетъчното унищожаване се индуцира от стрептозотоцин при мъжки миши модели на диабет с дефицит на инсулин (43, 44), тестостеронът ускорява хипергликемичната декомпенсация по AR-зависим начин. Съобщено е също така, че тестостеронът предпазва ранните апоптотични увреждания, индуцирани от стрептозотоцин в панкреаса при мъжки плъх чрез AR (45, 46). Предишен доклад също така предполага, че тестостеронът стимулира островния иРНК и съдържанието на инсулин в културата и in vivo (47). Следователно, ролята на AR в мъжките β-клетки е неясна. Създадохме β-клетъчна специфична AR нокаут мишка, за да изследваме пряката роля на AR в мъжката β-клетъчна физиология (βARKO -/y) (48). Мъжките βARKO -/y мишки проявяват намалена глюкозо-стимулирана секреция на инсулин (GSIS), водеща до непоносимост към глюкоза, и развиват β-клетъчна недостатъчност, за да компенсират индуцираната от диета инсулинова резистентност. Намаленият GSIS се възпроизвежда в култивирани мъжки острови βARKO -/y, както и в култивирани човешки островчета, третирани с флутамид, AR антагонист. Това предполага, че AR е физиологичен регулатор на мъжката β-клетъчна функция, находка, която има важни последици за превенцията на T2D при хипоандрогенни мъже.
Роля на AR в глюкозната хомеостаза при жените (фигура 2)
При жени с хиперандрогенемия, излишното AR активиране в скелетните мускули, макрофагите, панкреасните бета-клетки и метаболитните центрове в хипоталамуса синергизират за насърчаване на метаболитна дисфункция, възпаление, висцерално затлъстяване и T2D.
Хиперандрогенизмът предразполага към T2D при жените
Ролята на дефицита на AR в женския метаболизъм не е добре проучена, въпреки че се съобщава, че няма ефект върху телесното тегло при женски мишки (49). За разлика от тях, връзката между андрогенния излишък и диабета при жените е известна още от ранното описание на „диабет при брадати жени“ от Ахард и Тиер през 1921 г. (4).
В проспективно 12-годишно проучване на шведски жени Bjorntorp и колеги първоначално съобщават, че ниската концентрация на глобулин, свързващ половия хормон (SHBG) - което повишава свободния тестостерон - е силен независим рисков фактор за развитието на T2D (50). По същия начин Larsson и Ahren показаха, че жените в постменопауза с нарушен глюкозен толеранс имат по-висока андрогенна активност от жените с нормален глюкозен толеранс и че андрогенната активност корелира със степента на непоносимост към глюкоза (51, 52). По-високите нива на свободен тестостерон и по-ниските нива на SHBG многократно са свързани с непоносимост към глюкоза и инсулинова резистентност при жените (53, 54, 55, 56, 57). В мета-анализ на наличните проспективни и напречни проучвания, свързани с нивата на тестостерон, SHBG и естрадиол с риск от T2D, Ding et al. съобщава, че високите нива на свободен тестостерон са свързани с по-висок риск от T2D при жените (8). Въпреки това, нивата на естрадиол също са били повишени сред жените с диабет в постменопауза, което предполага, че излишъкът от естроген също може да играе роля при риска от Т2D. При жените в постменопауза по-високите плазмени нива на естрадиол и тестостерон са силно и проспективно свързани с повишен риск от развитие на T2D (58).
Хиперандрогенизмът насърчава инсулиновата резистентност при жените
За да разберат ролята на андрогенния излишък в инсулиновата чувствителност, няколко групи са изследвали метаболитния отговор на изложени на андроген жени по време на хипергликемични и еугликемично-хиперинсулинемични скоби. В световен мащаб тези проучвания съобщават, че високите нива на тестостерон произвеждат инсулинова резистентност, като намаляват усвояването на глюкоза в цялото тяло при здрави жени преди и след менопаузата (54, 59, 60, 61). Освен това намаленото стимулирано с инсулин усвояване на глюкоза в цялото тяло не се дължи на чернодробната инсулинова резистентност, която остава непроменена, подкрепяйки ролята на скелетните мускули в инсулиновата резистентност (59). Ролята на излишния тестостерон за насърчаване на инсулиновата резистентност на скелетните мускули с превключвател тип влакна също е потвърдена в проучвания на женски гризачи (62, 63). И все пак механизмите, чрез които излишъкът на андроген стимулира мускулната инсулинова резистентност, остават неизвестни.
Въпреки натрупаните доказателства, че излишъкът от тестостерон променя инсулиновата чувствителност при жените, не е ясно дали излишъкът от тестостерон инициира инсулинова резистентност или го поддържа. Като цяло, чувствителността към инсулин се подобрява, когато хиперандрогенизмът е обърнат с антиандрогенна терапия, заедно със загуба на тегло (40, 64, 65). Последните проучвания предполагат, че излишъкът на андроген сам по себе си може да бъде от значение за инсулиновата резистентност. Лечението с AR антагонисти или потискане на производството на андроген в яйчниците с аналози на GnRH при хиперандрогенни жени не винаги подобрява инсулиновата резистентност (66), което предполага, че излишъкът на андрогени при жените може да не е причина за тези метаболитни аномалии, а по-скоро утежняващ фактор.
Хиперандрогенизмът увеличава висцералното затлъстяване при жените
Хиперандрогенизмът предразполага към дисфункция на β-клетките при жените
За да отговорим на ролята на β-клетъчната AR в β-клетъчната дисфункция при жени с излишък на андроген, генерирахме мишки с условен нокаут на AR в β-клетките. При женските мишки хроничният андрогенен излишък предизвиква хиперфункция на β-клетките и недостатъчност на островчетата, за да компенсира инсулиновата резистентност, предизвикана от хранене с високи мазнини, което води до T2D (80), подобно на наблюдаваното при жени с PCOS. Въпреки това, индуциран от излишък на андроген T2D не се наблюдава при женски βARKO -/- мишки. По този начин, при жени с излишък на андроген, предразположението към T2D е най-малко частично медиирано чрез излишък на AR активиране в β-клетките.
Заключения
Ясно е, че има двупосочна модулация на хомеостазата на глюкозата от андрогени при мъже и жени. Дефицитът на AR води до драстична метаболитна дисфункция при застаряващите мъже, но при жените не. Вероятно отразяващо по-ниската концентрация на тестостерон и DHT в циркулацията и клетките, AR активирането е по-слабо при жените и по този начин AR е по-малко важно за поддържане на енергийната хомеостаза при женските бозайници. И все пак, когато концентрациите на андроген се повишат до патологични нива при жените, произтичащото излишно активиране на AR води до метаболитна дисфункция. Доказателствата, представени в този преглед, показват, че андрогенният дефицит при мъжете и излишъкът на андроген при жените предизвикват метаболитна дисфункция чрез дефицитно или прекомерно действие на AR, в множество тъкани, включително централната нервна система, черния дроб, скелетните мускули, мастните и β-клетките. При мъжете лечението може да разчита на селективни модулатори на андрогенните рецептори (SARM). В случай на хиперандрогенни жени са необходими повече проучвания, за да се определи точната роля на андрогенното действие в централната нервна система, черния дроб, скелетните мускули, мастните и β-клетките за развитието на T2D.
Това, което вече е известно по този въпрос?
Дефицитът на андроген предразполага към метаболитен синдром и диабет тип 2 при мъжете.
Излишъкът на андроген предразполага към метаболитен синдром и диабет тип 2 при жените.
- Връзката между диабет и затлъстяване Главна практика за първична медицинска помощ
- Влиянието на затлъстяването и захарния диабет върху рака на панкреаса Молекулярни механизми и клинични
- Връзката между затлъстяването и диабета Nova Wellness Center Специалисти по отслабване
- Връзката между затлъстяването и диабета - сериозна наука
- Връзката между затлъстяването и диабета Medinet Family Care Clinic Спешна помощ