Кореспонденция на: Deanna L Gibson, PhD, асистент, Катедра по биология, Университет на Британска Колумбия Okanagan, Kelowna V1V 1V7, Британска Колумбия, Канада. [email protected]
Телефон: + 1-250-8078790 Факс: + 1-250-8078005
Резюме
Основен съвет: Чревната алкална фосфатаза (IAP) е важна за здравето на червата. Ролята на IAP в червата включва както защита от системни инфекции, така и хронични възпалителни заболявания като възпалително заболяване на червата. Налице е сложно взаимодействие между IAP, диета, микробиота и чревния епител, което ускори изследванията на IAP като потенциално терапевтично средство срещу тези причини. Целта на този преглед е да подчертае основните характеристики на IAP при поддържане на хомеостазата в червата, като същевременно се обърне внимание на сложното взаимодействие между IAP, диета, микробиота и чревен епител.
ЧРЕВНА АЛКАЛНА ФОСФАТАЗА
Алкалните фосфатази (AP) са хидролазни ензими, които катализират разграждането на монофосфатни естери чрез отстраняване на техните фосфатни групи. AP са групирани в два класа: тъканните неспецифични алкални фосфатази (TNAP), които се изразяват в кост; черен дроб; и бъбречни [1] и тъканно специфични изозими, които включват плацентарна алкална фосфатаза (PLAP), алкална фосфатаза на зародишните клетки; и чревна алкална фосфатаза (IAP).
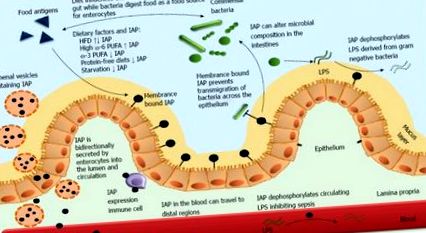
Чревната алкална фосфатаза регулира чревната хомеостаза. Чревната алкална фосфатаза (IAP), секретирана от ентероцитите, играе жизненоважна роля в различни физиологични функции в и около червата. Въпреки че основно се свързва с мембраната, IAP може да се намери както в лумена, така и в кръвта. Висока концентрация на IAP молекули присъства в богатите на протеини луменални везикули от луменалната и апикалната страна на епитела. IAP дефосфорилира както луменалните, така и циркулиращите липополизахариди (LPS), получени от клетъчната стена на грам отрицателни бактерии, ефективно елиминирайки тяхната токсична съставка. Предварителната работа от нашата лаборатория и други показаха, че IAP, експресиран върху инфилтрирани имуноцити в lamina propria. IAP също е от решаващо значение за предотвратяване на трансмиграцията на бактерии през епителния слой, предотвратяване на активирането на имуноцитите надолу по веригата и последващите възпалителни реакции. Чрез сложната си връзка с храната, коменсалните бактерии и имунните клетки, IAP играе съществена роля в хомеостазата на червата.
IAP е най-еволюционно запазеният от AP, споделящ 89,5% от своите аминокиселинни последователности с PLAP [13], при хората тези гени са разположени в хромозома 2 [14]. За разлика от тях, типовете TNAP споделят само 50% от своите аминокиселини с IAP [13] и са разположени в хромозома 4 [14]. Това показва еволюционно разделение между тъканно специфични и тъканни неспецифични изотипове. IAP ензимът при хората се кодира от гена ALPI [15], докато при мишки са идентифицирани два изоензима: дуоденален IAP (dIAP) и глобален IAP (gIAP). DIAP и gIAP на мишки споделят 79% генетична хомология [16] и са кодирани съответно от гените Akp3 и Akp6 [17,18]. Има и два известни IAP изоензима при плъхове: IAP I и IAP II, кодирани съответно от гените alpi1 и alpi2. Филогенетичните сравнения показват, че gIAP на мишката е подобен както на dIAP на мишка, така и на IAP I на плъх, но не и на IAP при хора. Като цяло, повечето проучвания на мишки са фокусирани върху IAP като цяло, а не върху специфичните изоформи и в резултат специфичната функция на всеки изозим е слабо разбрана. Неотдавнашните прегледи подчертаха значението на IAP в хомеостазата на червата [19,20].
IAP, ЛИПОПОЛИЗАХАРИД И ИНФЕКЦИЯ
IAP И ВЪЗПАЛЕНИЕ
IAP И ХРОНИЧНИ ВЪЗПАЛИТЕЛНИ БОЛЕСТИ
Чревната хомеостаза е жизненоважна за поддържането на балансиран метаболизъм, не е изненадващо, че наскоро ендогенната IAP е замесена в метаболитните синдроми [36]. В елегантна поредица от проучвания на Kaliannan et al [36] беше показано, че IAP нокаутиращите (KO) мишки показват характеристики на метаболитен синдром като: затлъстяване, повишена кръвна глюкоза, ендотоксемия, непоносимост към глюкоза и хиперинсулинемия. Допълването с перорален IAP успя да предотврати и обърне тези състояния както при KO мишки, така и при модели на HFD-индуциран метаболитен синдром.
ВАП, МИКРОБИОТА И ЧРЕВНА ХОМЕОСТАЗА
ИНТЕРПЕЙ МЕЖДУ ХРАНА И IAP
Консумацията на протеини също може да играе важна роля в регулирането на ВАП. Плъхове, хранени с диети без протеини, показват 36% -38% намаляване на активността на IAP [43]. В този експеримент обаче диетите на плъхове са били с високо съдържание на нишесте и следователно нивата на IAP могат да бъдат променени поради високи нива на въглехидрати, а не поради липсата на протеин. Тези резултати, взети заедно, предполагат, че има сложна взаимовръзка между диетата и активността на IAP и че персонализираните диети могат да бъдат полезни при регулирането на нивата на IAP.
IAP КАТО ТЕРАПЕВТИЧЕН АГЕНТ
Има все повече доказателства, че приложението на IAP по време на инфекция и възпаление може да бъде нова терапевтична стратегия за намаляване на усложненията на заболяването. Добавянето на IAP може също да бъде ефективно средство за борба с нарастващия проблем на инфекции, свързани с антибиотици, като свързани с C. difficile заболявания (CDAD). В подкрепа на това беше показано, че оралното приложение на IAP едновременно с антибиотици при мишки напълно предотвратява CDAD, както и други ентерични патогени като Salmonella Typhimurium [37]. Това е от решаващо значение, тъй като прилагането на антибиотици може да предизвика микробен дисбаланс в червата, известен като дисбиоза. Това създава благоприятна среда за патогени и увеличава чувствителността на гостоприемника към инфекция.
маса 1
Резюме на завършени и текущи клинични изпитвания при хора, използващи екзогенна алкална фосфатаза от говежди чревни организми
- Симптоми с висока алкална фосфатаза; Как да го намаля - SelfHacked
- Диетата на чревните бъгове може да повлияе на изследването на чревната пропускливост
- Включете тези 5 билки във вашата диета за подобрен имунитет Health Food Manorama English
- Заздравяване на язви с алкална диета
- Подобрете имунитета си с промени в диетата и начина на живот