Резюме
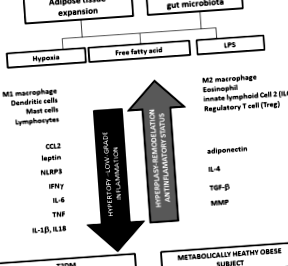
Затлъстяването и съпътстващите го заболявания са тясно свързани с възпалителната среда, създадена от разширена мастна тъкан. Няколко механизма предизвикват възпаление в мастната тъкан, включително излишните мастни киселини, хипоксията и активирането на инфламазома. Възпалението се характеризира с изобилие от имунни клетки, особено М1 макрофаги и Т лимфоцити, които имат повишена секреция на провъзпалителни цитокини, които действат за поддържане на системно възпаление и предизвикват инсулинова резистентност. Чревната микробиота също участва в предизвикано от затлъстяване възпаление чрез свързана с LPS ендотоксемия, която индуцира секреция на цитокини и инсулинова резистентност. Вродените лимфоидни клетки тип 2, регулаторните Т-клетки и интерлевкин (IL) -10 противодействат на възпалението и инсулиновата резистентност, установявайки класическо или метаболитно здравословно затлъстяване.
Това е визуализация на абонаментното съдържание, влезте, за да проверите достъпа.
Опции за достъп
Купете единична статия
Незабавен достъп до пълната статия PDF.
Изчисляването на данъка ще бъде финализирано по време на плащане.
Абонирайте се за списание
Незабавен онлайн достъп до всички издания от 2019 г. Абонаментът ще се подновява автоматично ежегодно.
Изчисляването на данъка ще бъде финализирано по време на плащане.
Препратки
Докладите от особен интерес, публикувани наскоро, бяха подчертани като: • От значение •• От голямо значение
de Heredia FP, Gomez-Martinez S, Marcos A. Затлъстяване, възпаление и имунна система. Proc Nutr Soc. 2012; 71: 332–8.
Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokines при възпаление и метаболитно заболяване. Nat Rev Immunol. 2011; 11: 85–97.
Fain, J.N. Освобождаването на възпалителни медиатори от човешката мастна тъкан се засилва при затлъстяване и главно от обезмаслените клетки: преглед. Посредници Възпаление 2010 г., 513948.
ван Greevenbroek MM, Schalkwijk CG, Stehouwer CD. Нискостепенно възпаление, свързано със затлъстяването при захарен диабет тип 2: причини и последици. Neth J Med. 2013; 71: 174–87.
Bigornia SJ, Farb MG, Mott MM, Hess DT, Carmine B, Fiscale A, et al. Връзка на депо-специфичното мастно възпаление с инсулиновата резистентност при затлъстяването при хора. Nutr Диабет. 2012; 2: e30.
Despres JP, Lemieux I, Bergeron J, Pibarot P, Mathieu P, Larose E, et al. Коремното затлъстяване и метаболитният синдром: принос към глобалния кардиометаболитен риск. Arterioscler Thromb Vasc Biol. 2008; 28: 1039–49.
Marinou K, Tousoulis D, Antonopoulos AS, Stefanadi E, Stefanadis C. Затлъстяването и сърдечно-съдовите заболявания: от патофизиология до стратификация на риска. Int J Cardiol. 2010; 138: 3–8.
Primeau V, Coderre L, Karelis AD, Brochu M, Lavoie ME, Messier V, et al. Характеризиращ профила на пациенти със затлъстяване, които са метаболитно здрави. Int J Obes (Лонд). 2011; 35: 971–81.
Zeyda M, Stulnig TM. Затлъстяване, възпаление и инсулинова резистентност - мини преглед. Геронтология. 2009; 55: 379–86.
Girard J, Lafontan M. Влияние на висцералната мастна тъкан върху метаболизма на черния дроб и инсулиновата резистентност. Част II: Производство на висцерална мастна тъкан и метаболизъм в черния дроб. Диабет Metab. 2008; 34: 439–45.
Coelho M, Oliveira T, Fernandes R. Биохимия на мастната тъкан: ендокринен орган. Arch Med Sci. 2013; 9: 191–200.
Li ZY, Wang P, Miao CY. Адипокини при възпаление, инсулинова резистентност и сърдечно-съдови заболявания. Clin Exp Pharmacol Physiol. 2011; 38: 888–96.
Lemoine AY, Ledoux S, Larger E. Ангиогенеза на мастната тъкан при затлъстяване. Thromb Haemost. 2013; 110.
Gualillo O, Gonzalez-Juanatey JR, Lago F. Възникващата роля на адипокините като медиатори на сърдечно-съдовата функция: физиологични и клинични перспективи. Тенденции Cardiovasc Med. 2007; 17: 275–83.
Pujanek M, Bronisz A, Malecki P, Junik R. Патомеханизми на развитието на затлъстяването в някои ендокринопатии - преглед. Ендокринол Pol. 2013; 64: 150–5.
Leal Vde O, Mafra D. Адипокини при затлъстяване. Clin Chim Acta. 2013; 419: 87–94.
Юнг CH, Ким MS. Молекулни механизми на централна лептинова резистентност при затлъстяване. Arch Pharm Res. 2013; 36: 201–7.
D’Ippolito S, Tersigni C, Scambia G, Di Simone N. Adipokines, мастна тъкан и плацентарен продукт с биологични функции по време на бременност. Биофактори. 2012; 38: 14–23.
Ye J, McGuinness OP. Възпалението по време на затлъстяване не е лошо: доказателства от проучвания върху животни и хора. Am J Physiol Endocrinol Metab. 2013; 304: E466–77.
Васкес-Вела ME, Torres N, Tovar AR. Бялата мастна тъкан като ендокринен орган и нейната роля при затлъстяването. Arch Med Res. 2008; 39: 715–28.
Yadav A, Kataria MA, Saini V. Роля на лептина и адипонектина в инсулиновата резистентност. Clin Chim Acta. 2013; 417: 80–4.
Lenz A, Diamond Jr FB. Затлъстяването: хормоналната среда. Curr Opin Endocrinol Diabetes Obes. 2008; 15: 9–20.
Yamauchi T, Kadowaki T. Физиологични и патофизиологични роли на адипонектиновите и адипонектиновите рецептори в интегрираната регулация на метаболитните и сърдечно-съдовите заболявания. Int J Obes (Лонд). 2008; 32 Suppl 7: S13–8.
Lago F, Gomez R, Gomez-Reino JJ, Dieguez C, Gualillo O. Adipokines като нови модулатори на липидния метаболизъм. Тенденции Biochem Sci. 2009; 34: 500–10.
Pereira SS, Alvarez-Leite JI. Адипокини: биологични функции и метаболитно здрав профил на затлъстяването. J Recept Ligand Channel Res. 2014; 7: 1–11.
Галич S, Oakhill JS, Steinberg GR. Мастната тъкан като ендокринен орган. Ендокринол на Mol Cell. 2010; 316: 129–39.
Zou C, Shao J. Роля на адипоцитокините в свързаната със затлъстяването инсулинова резистентност. J Nutr Biochem. 2008; 19: 277–86.
Maury E, Brichard SM. Дисрегулация на адипокин, възпаление на мастната тъкан и метаболитен синдром. Ендокринол на Mol Cell. 2010; 314: 1–16.
Balistreri CR, Caruso C, Candore G. Ролята на мастната тъкан и адипокините при свързани със затлъстяването възпалителни заболявания. Mediat възпаление. 2010; 2010: 802078.
Guilherme A, Virbasius JV, Puri V, чешки депутат. Адипоцитни дисфункции, свързващи затлъстяването с инсулинова резистентност и диабет тип 2. Nat Rev Mol Cell Biol. 2008; 9: 367–77.
Hermsdorff HH, Angeles Zulet M, Bressan J, Alfredo Martinez J. Ефект на диетата върху нискостепенното и хронично възпаление, свързано със затлъстяването и метаболитния синдром. Ендокринол Nutr. 2008; 55: 409–19.
Bray GA, Clearfield MB, Fintel DJ, Nelinson DS. Наднормено тегло и затлъстяване: патогенезата на кардиометаболитен риск. Clin Cornerstone. 2009; 9: 30–40. дискусия 41–32.
Lee J. Макрофаги на мастната тъкан в развитието на индуцирано от затлъстяване възпаление, инсулинова резистентност и диабет тип 2. Arch Pharm Res. 2013; 36: 208–22.
Sun S, Ji Y, Kersten S, Qi L. Механизми на възпалителни реакции в затлъстялата мастна тъкан. Annu Rev Nutr. 2012; 32: 261–86.
Kanda H, Tateya S, Tamori Y, Kotani K, Hiasa K, Kitazawa R, et al. MCP-1 допринася за инфилтрация на макрофаги в мастната тъкан, инсулинова резистентност и чернодробна стеатоза при затлъстяване. J Clin Invest. 2006; 116: 1494–505.
Itoh M, Suganami T, Hachiya R, Ogawa Y. Ремоделиране на мастната тъкан като хомеостатично възпаление. Int J Възпаление. 2011; 2011: 720926.
Feuerer M, Herrero L, Cipolletta D, Naaz A, Wong J, Nayer A, et al. Слабите, но не затлъстели мазнини се обогатяват за уникална популация от регулаторни Т клетки, които влияят на метаболитните параметри. Nat Med. 2009; 15: 930–9.
Gotoh K, Inoue M, Masaki T, Chiba S, Shimasaki T, Ando H, et al. Нова противовъзпалителна роля за интерлевкин-10, получен от далак, при индуцирано от затлъстяване възпаление в бялата мастна тъкан и черния дроб. Диабет. 2012; 61: 1994–2003.
Chen W, Konkel JE. TGF-бета и „адаптивни“ Foxp3 (+) регулаторни Т клетки. J Mol Cell Biol. 2010; 2: 30–6.
Chen X, Oppenheim JJ. Разрешаване на мита за идентичността: ключови маркери на функционални CD4 + FoxP3 + регулаторни Т клетки. Int Immunopharmacol. 2011; 11: 1489–96.
Yadav H, Quijano C, Kamaraju AK, Gavrilova O, Malek R, Chen W, et al. Защита от затлъстяване и диабет чрез блокиране на сигнализирането на TGF-бета/Smad3. Cell Metab. 2011; 14: 67–79.
Tan CK, Chong HC, Tan EH, Tan NS. Получаване на "Smad" за затлъстяването и диабета. Nutr Диабет. 2012; 2: e29.
Cristancho AG, Lazar MA. Формиране на функционални мазнини: нарастващо разбиране за диференциацията на адипоцитите. Nat Rev Mol Cell Biol. 2011; 12: 722–34.
Chmelar J, Chung KJ, Chavakis T. Ролята на вродените имунни клетки при възпаление на мастната тъкан със затлъстяване и развитие на инсулинова резистентност. Thromb Haemost. 2013; 109: 399–406.
Kalupahana NS, Moustaid-Moussa N, Claycombe KJ. Имунитетът като връзка между затлъстяването и инсулиновата резистентност. Mol Aspects Med. 2012; 33: 26–34.
Харфорд KA, Рейнолдс CM, McGillicuddy FC, Roche HM. Мазнини, възпаление и инсулинова резистентност: прозрения за ролята на натрупването на макрофаги и Т-клетки в мастната тъкан. Proc Nutr Soc. 2011; 70: 408–17.
Cinti S, Mitchell G, Barbatelli G, Murano I, Ceresi E, Faloia E, et al. Смъртта на адипоцитите определя локализацията и функцията на макрофагите в мастната тъкан на затлъстели мишки и хора. J Lipid Res. 2005; 46: 2347–55.
Lolmede K, Duffaut C, Zakaroff-Girard A, Bouloumie A. Имунни клетки в мастната тъкан: ключови играчи при метаболитни нарушения. Диабет Metab. 2011; 37: 283–90.
Bertola A, Ciucci T, Rousseau D, Bourlier V, Duffaut C, Bonnafous S, et al. Идентифицирането на дендритни клетки на мастната тъкан корелира със свързаната със затлъстяването инсулинова резистентност и предизвиква Th17 отговори при мишки и пациенти. Диабет. 2012; 61: 2238–47. Тази статия показва за първи път наличието на специфични DC в мастната тъкан при затлъстяване при мишки и хора.
Patel PS, Buras ED, Balasubramanyam A. Ролята на имунната система при затлъстяване и инсулинова резистентност. J Обес. 2013; 2013: 616193.
Chen Y, Tian J, Tian X, Tang X, Rui K, Tong J, et al. Дендритните клетки на мастната тъкан усилват възпалението, като подтикват генерирането на Th17 клетки. PLOS ONE. 2014; 9: e92450. Резултатите от това проучване показват съществуването на CD11c + DCs в мастната тъкан, която показва незрял фенотип, но притежаващ противовъзпалителна функция.
Talukdar S, Oh DY, Bandyopadhyay G, Li D, Xu J, McNelis J, et al. Неутрофилите медиират инсулинова резистентност при мишки, хранени с високо съдържание на мазнини чрез секретирана еластаза. Nat Med. 2012; 18: 1407–12. Авторите показват, че лечението на хепатоцити с неутрофилна еластаза причинява инсулинова резистентност и че делецията на неутрофилна еластаза при затлъстели мишки намалява възпалението.
Wu D, Molofsky AB, Liang HE, Ricardo-Gonzalez RR, Jouihan HA, Bando JK, et al. Еозинофилите поддържат адипозни алтернативно активирани макрофаги, свързани с глюкозната хомеостаза. Наука. 2011; 332: 243–7.
Molofsky AB, Nussbaum JC, Liang HE, Van Dyken SJ, Cheng LE, Mohapatra A, et al. Вродените лимфоидни клетки тип 2 поддържат висцерални мастни тъкани еозинофили и алтернативно активирани макрофаги. J Exp Med. 2013; 210: 535–49.
Moro K, Yamada T, Tanabe M, Takeuchi T, Ikawa T, Kawamoto H, et al. Вродено производство на Т (Н) 2 цитокини от свързани с мастната тъкан c-Kit (+) Sca-1 (+) лимфоидни клетки. Природата. 2010; 463: 540–4.
Winer S, Chan Y, Paltser G, Truong D, Tsui H, Bahrami J, et al. Нормализиране на свързаната със затлъстяването инсулинова резистентност чрез имунотерапия. Nat Med. 2009; 15: 921–9.
Cipolletta D, Feuerer M, Li A, Kamei N, Lee J, Shoelson SE, et al. PPAR-гама е основен двигател на натрупването и фенотипа на Treg клетки на мастната тъкан. Природата. 2012; 486: 549–53.
Eller K, Kirsch A, Wolf AM, Sopper S, Tagwerker A, Stanzl U, et al. Потенциална роля на регулаторните Т клетки в обръщането на свързаната със затлъстяването инсулинова резистентност и диабетна нефропатия. Диабет. 2011; 60: 2954–62.
Cipolletta D, Kolodin D, Benoist C, Mathis D. Tissular T (regs): уникална популация от жители на мастна тъкан Foxp3 + CD4 + T клетки, които влияят на метаболизма на организма. Semin Immunol. 2011; 23: 431–7.
Deiuliis J, Shah Z, Shah N, Needleman B, Mikami D, Narula V, et al. Висцералното мастно възпаление при затлъстяване е свързано с критични промени в броя на трегулационните клетки. PLOS ONE. 2011; 6: e16376.
Tiemessen MM, Jagger AL, Evans HG, van Herwijnen MJ, John S, Taams LS. CD4 + CD25 + Foxp3 + регулаторни Т клетки индуцират алтернативно активиране на човешки моноцити/макрофаги. Proc Natl Acad Sci U S A. 2007; 104: 19446–51.
Chen, X., Wu, Y. и Wang, L. Tregs, пребиваващи в мазнини: нововъзникващ пазач, предпазващ от метаболитни нарушения, свързани със затлъстяването. Obes Rev. 2013; 14: 568–78.
Huh JY, Park YJ, Ham M, Kim JB. Кръстосана връзка между адипоцитите и имунните клетки при възпаление на мастната тъкан и метаболитна дисрегулация при затлъстяване. Мол клетки. 2014; 37 (5): 365–71.
Nishimura S, Manabe I, Nagasaki M, Eto K, Yamashita H, Ohsugi M, et al. CD8 + ефекторните Т клетки допринасят за набирането на макрофаги и възпалението на мастната тъкан при затлъстяване. Nat Med. 2009; 15: 914–20.
Kotas ME, Lee HY, Gillum MP, Annicelli C, Guigni BA, Shulman GI, et al. Влияние на дефицита на CD1d върху метаболизма. PLOS ONE. 2011; 6: e25478.
Mantell BS, Стефанович-Рачич M, Yang X, Dedousis N, Sipula IJ, O’Doherty RM. Мишките, в които липсват NKT клетки, но с пълен набор от CD8 + Т-клетки, не са защитени срещу метаболитните аномалии на индуцирано от диетата затлъстяване. PLOS ONE. 2011; 6: e19831.
Нишимура, С., Манабе, И., Такаки, С., Нагасаки, М., Оцу, М., Ямашита, Х., Сугита, Дж., Йошимура, К., Ето, К., Комуро, И., и др. (2013). Мастните естествени регулаторни B клетки отрицателно контролират възпалението на мастната тъкан. Cell Metab.
Liu J, Divoux A, Sun J, Zhang J, Clément K, Glickman JN, et al. Генетичният дефицит и фармакологичната стабилизация на мастоцитите намаляват затлъстяването и диабета, предизвикано от мишки. Nat Med. 2009; 15: 940–5.
Робинс GR, Wen H, Ting JP. Възпаления и метаболитни нарушения: стари гени в съвременните болести. Мол клетка. 2014; 54: 297–308.
Wieser V, Moschen AR, Tilg H. Възпаление, цитокини и инсулинова резистентност: клинична перспектива. Arch Immunol Ther Exp (Warsz). 2013; 61: 119–25.
Skeldon AM, Faraj M, Saleh M. Каспази и инфламазоми при метаболитно възпаление. Имунолни клетъчни биол. 2014; 92: 304–13.
Jin C, Flavell RA. Вродени сензори за патоген и стрес: свързване на възпалението със затлъстяването. J Allergy Clin Immunol. 2013; 132: 287–94.
Stienstra R, van Diepen JA, Tack CJ, Zaki MH, van de Veerdonk FL, Perera D, et al. Inflammasome е централен играч в индуцирането на затлъстяване и инсулинова резистентност. Proc Natl Acad Sci U S A. 2011; 108: 15324–9.
Koenen TB, Stienstra R, van Tits LJ, Joosten LA, van Velzen JF, Hijmans A, et al. Активирането на инфламазома и каспаза-1: нов механизъм в основата на повишената възпалителна активност в човешката висцерална мастна тъкан. Ендокринология. 2011; 152: 3769–78.
Vandanmagsar B, Youm YH, Ravussin A, Galgani JE, Stadler K, Mynatt RL, et al. NLRP3 възпалителният стимул предизвиква затлъстяване възпаление и инсулинова резистентност. Nat Med. 2011; 17: 179–88.
Tilg, H. и Moschen, AR. Микробиота и диабет: променяща се връзка. Червата. 2014 г. Докладът прави преглед на ролята на микробиотата при диабета и предоставя нови аспекти по отношение на нейното патофизиологично значение.
Remely M, Aumueller E, Jahn D, Hippe B, Brath H, Haslberger AG. Микробиота и епигенетична регулация на възпалителни медиатори при диабет тип 2 и затлъстяване. Благотворни микроби. 2014; 5: 33–43.
Moreno-Indias I, Cardona F, Tinahones FJ, Queipo-Ortuño MI. Влияние на чревната микробиота върху развитието на затлъстяване и захарен диабет тип 2. Преден микробиол. 2014; 5: 190.
Kemp DM. Хроничната нискостепенна ендотоксемия определя ли податливостта на затлъстелите хора към инсулинова резистентност чрез диетични ефекти върху чревната микробиота? Адипоцит. 2013; 2: 188–90.
Jumpertz R, Le DS, Turnbaugh PJ, Trinidad C, Bogardus C, Gordon JI, et al. Изследванията на енергийния баланс разкриват връзките между чревните микроби, калоричното натоварване и усвояването на хранителни вещества при хората. Am J Clin Nutr. 2011; 94: 58–65.
Furet JP, Kong LC, Tap J, Poitou C, Basdevant A, Bouillot JL и др. Диференциална адаптация на човешката чревна микробиота към индуцирана от бариатрична хирургия загуба на тегло: връзки с метаболитни и нискостепенни маркери за възпаление. Диабет. 2010; 59: 3049–57.
Mai V, McCrary QM, Sinha R, Glei M. Асоциации между диетичните навици и индекса на телесна маса със състава на микробиотата в червата и генотоксичността на фекалните води: наблюдателно проучване при афроамерикански и кавказкоамерикански доброволци. Nutr J. 2009; 8: 49.
Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, et al. Промените в чревната микробиота контролират възпалението, предизвикано от метаболитна ендотоксемия, при затлъстяване и диабет при мишки с високо съдържание на мазнини. Диабет. 2008; 57: 1470–81.
Mehta NN, Heffron SP, Patel PN, Ferguson J, Shah RD, Hinkle CC, et al. Човешки модел на възпалителна кардио-метаболитна дисфункция; двойно сляпо плацебо контролирано кросоувър изпитание. J Transl Med. 2012; 10: 124.
Mehta NN, McGillicuddy FC, Anderson PD, Hinkle CC, Shah R, Pruscino L, et al. Експерименталната ендотоксемия предизвиква мастно възпаление и инсулинова резистентност при хората. Диабет. 2010; 59: 172–81.
Turnbaugh PJ, Bäckhed F, Fulton L, Gordon JI. Индуцираното от диетата затлъстяване е свързано с подчертани, но обратими промени в дисталния чревен микробиом на мишката. Клетъчен домакин Микроб. 2008; 3: 213–23.
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Чревен микробиом, свързан със затлъстяването, с повишен капацитет за енергийна реколта. Природата. 2006; 444: 1027–31.
Lee MJ, Wu Y, Fried SK. Ремоделиране на мастната тъкан в патофизиологията на затлъстяването. Curr Opin Clin Nutr Metab Care. 2010; 13: 371–6.
Sun K, Kusminski CM, Scherer PE. Реконструкция на мастната тъкан и затлъстяване. J Clin Investig. 2011; 121: 2094–101.
Bluher M. Разграничението на метаболитно „здрави“ от „нездравословни“ индивиди със затлъстяване. Curr Opin Lipidol. 2010; 21: 38–43.
Pataky Z, Bobbioni-Harsch E, Golay A. Отворени въпроси за метаболитно нормалното затлъстяване. Int J Obes (Лонд). 2010; 34 Suppl 2: S18–23.
Esser N, L’homme L, De Roover A, Kohnen L, Scheen AJ, Moutschen M, et al. Фенотипът на затлъстяването е свързан с възпалителната активност на NLRP3 и имунологичния профил на висцералната мастна тъкан. Диабетология. 2013; 56: 2487–97.
Pereira SS, Teixeira LG, Aguilar EC, Chaves OM, Savassi-Rocha AL, Pelaez JMN, et al. Модулация на възпалението на мастната тъкан от клетки Foxp3 + Treg, Il-10 и Tgfβ при индивиди с метаболитно здравословно затлъстяване от клас III. Хранене. 2014. doi: 10.1016/j.nut.2013.11.023. Тази статия изследва висцералната и подкожната мастна тъкан от индивиди със затлъстяване степен III, показващи, че Treg и IL10 са важни за контролиране на възпалението при тези индивиди.
Спазване на етичните насоки
Конфликт на интереси
Соланж С. Перейра и Жаклин I Алварес-Лейте заявяват, че нямат конфликт на интереси.
Права на човека и животните и информирано съгласие
Тази статия не съдържа изследвания с хора или животни, извършени от някой от авторите.
Информация за автора
Принадлежности
Департамент по биохимия и имунология, Университет Федерален де Минас Жерайс, Caixa Пощенски 486, 30161-970, Бело Оризонти, Бразилия
Solange S. Pereira & Jacqueline I. Alvarez-Leite
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
- Хипоталамусното възпаление при човешкото затлъстяване се медиира от диабет на околната среда и генетични фактори
- Лираглутид за диабет тип 2 и затлъстяване актуализация от 2015 г. - PubMed
- Лираглутид е ефективно лекарство за лечение на затлъстяване и в реалния живот SpringerLink
- Само малко пиене може да доведе до затлъстяване, диабет и високо кръвно налягане
- Чревните хормони като терапевтични средства при лечение на диабет и затлъстяване - ScienceDirect