Guizhi Zhu
лаборатория по молекулярно изобразяване и наномедицина, Национален институт по биомедицинско изобразяване и биоинженерство (NIBIB), Национални здравни институти (NIH), Bethesda, MD 20892; Тел: (+1) 301-451-4246
Yijing Liu
лаборатория по молекулярно изобразяване и наномедицина, Национален институт по биомедицинско изобразяване и биоинженерство (NIBIB), Национални здравни институти (NIH), Bethesda, MD 20892; Тел: (+1) 301-451-4246
Xiangyu Yang
лаборатория по молекулярно изобразяване и наномедицина, Национален институт по биомедицинско изобразяване и биоинженеринг (NIBIB), Национални здравни институти (NIH), Bethesda, MD 20892; Тел: (+1) 301-451-4246
Йънг-Хва Ким
лаборатория по молекулярно изобразяване и наномедицина, Национален институт по биомедицинско изобразяване и биоинженерство (NIBIB), Национални здравни институти (NIH), Bethesda, MD 20892; Тел: (+1) 301-451-4246
Хуймин Джанг
лаборатория по молекулярно изобразяване и наномедицина, Национален институт по биомедицинско изобразяване и биоинженерство (NIBIB), Национални здравни институти (NIH), Bethesda, MD 20892; Тел: (+1) 301-451-4246
Руй Джиа
b Раздел за вътреклетъчен трафик на протеини, програма за клетъчна биология и метаболизъм, Национален институт за детско здраве и човешко развитие, NIH, Bethesda, MD 20892
Сиен-Шун Ляо
c Лаборатория за клетъчно изобразяване и макромолекулярна биофизика, NIBIB, NIH, Bethesda, MD 20892
Алберт Джин
c Лаборатория за клетъчно изобразяване и макромолекулярна биофизика, NIBIB, NIH, Bethesda, MD 20892
Дзин Лин
c Лаборатория за клетъчно изобразяване и макромолекулярна биофизика, NIBIB, NIH, Bethesda, MD 20892
Мария Аронова
c Лаборатория за клетъчно изобразяване и макромолекулярна биофизика, NIBIB, NIH, Bethesda, MD 20892
Ричард Лийпман
c Лаборатория за клетъчно изобразяване и макромолекулярна биофизика, NIBIB, NIH, Bethesda, MD 20892
Zhihong Nie
d Катедра по химия и биохимия, Университет на Мериленд, Колидж Парк, MD 20742
Банда Ниу
лаборатория по молекулярно изобразяване и наномедицина, Национален институт по биомедицинско изобразяване и биоинженерство (NIBIB), Национални здравни институти (NIH), Bethesda, MD 20892; Тел: (+1) 301-451-4246
Сяоюан Чен
лаборатория по молекулярно изобразяване и наномедицина, Национален институт по биомедицинско изобразяване и биоинженерство (NIBIB), Национални здравни институти (NIH), Bethesda, MD 20892; Тел: (+1) 301-451-4246
Свързани данни
Резюме
Въведение
Имунната система се развива като цялостна защитна мрежа, защитаваща гостоприемника от различни заболявания, включително рак. Имунната система обаче често е компрометирана при пациенти с рак чрез имуносупресивна туморна микросреда 1, в която липсват антитуморни цитотоксични CD8 + Т клетки и съдържа излишък от инфилтриращи тумора лимфоцити (TIL), като регулаторни Т клетки и супресорни клетки, получени от миелоиди. Следователно, тези усложнения потискат противораковите имунни отговори и насърчават имунното избягване и онкогенезата 2. Съвременното лечение на първичен рак, като операция, химиотерапия и лъчетерапия, има ограничена ефикасност за решаване на тези усложнения. Като алтернатива, раковата имунотерапия се опитва да нормализира и впрегне имунната система за борба с рака.
Независимо от това, развитието на CpG-базирана имунотерапия на рак е изправено пред множество предизвикателства, главно включително неблагоприятна фармакокинетика, системни странични ефекти и неефективно вътреклетъчно доставяне в APC 13, 14. Например, с присъщ отрицателен заряд, синтетичните молекулярни CpGs имат ограничена ефективност, за да бъдат интернализирани в APC за разпознаване на TLR9; все пак, TLR9 са еволюционно експресирани в клетките (върху ендолизозомни мембрани) за откриване на вътреклетъчни „чужди“ молекули, като ДНК на патогена. Освен това, конвенционалните молекулярни CpGs могат да предизвикат само временни имунни отговори, поради бърз клирънс, кратко време на задържане на тъканите, чувствителност към нуклеаза и присъщи временно вродени имунни отговори, индуцирани от CpGs. Освен това, CpGs, които са изтекли в системна циркулация, могат да стимулират В-клетките и плазмоцитоидните дендритни клетки да експресират провъзпалителни медиатори и да причинят странични ефекти. За да се справят с тези предизвикателства, настоящите подходи включват химическа модификация на CpG 15–17 или включване на CpG 18–25 в наноносители. По-специално, наноносителите са потенциални за удължаване на времето за задържане на тъканите на заредените терапевтични средства и за намаляване на експозицията на CpG в системното кръвообращение.
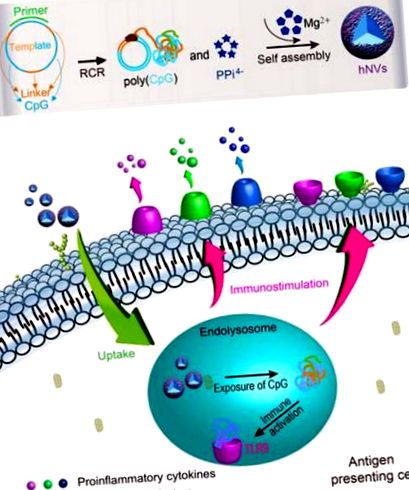
Тук представяме развитието на ДНК-неорганични хибридни нановаксини (hNV), които обещават да разрешат горните усложнения. Тези hNV са вътрешно имплантирани с аналози на CpG и защитни Mg2PPi за имунотерапия на рак (схема на фиг. 1). Ние демонстрирахме ефективно клетъчно поемане на hNVs в два основни типа APCs, дендритни клетки и макрофаги, а CpG аналозите бяха изложени от приетите hNVs в ендолизозомата, което води до мощна имуностимулация, както се доказва от драстично повишена секреция на провъзпалителни фактори и костимулиращи фактори . In vivo фармакокинетичното изобразяване доказва продължително задържане на тумор на hNV при мишки и hNVs допълнително е показано, че имат по-малка системна токсичност от молекулярния CpG аналог. Проучването за туморна имунотерапия демонстрира мощна имунотерапевтична ефикасност на hNVs при рак. Освен това hNVs се отличават с висока товароносимост на CpG аналози и висока стабилност в резултат на биоминерализация на CpG аналози от Mg2PPi. Като цяло тези характеристики правят hNVs обещаващи за мощна имунотерапия при рак.
Илюстрация на самостоятелно сглобени hNV за ракова имунотерапия. Сферичните hNV се сглобяват самостоятелно от комплексирането на аналози на конкатемерна ДНК CpG и неразтворим във вода Mg2PPi чрез едноетапна ензимна реакция: RCR. Използвайки кръгъл шаблон на ДНК, RCR едновременно произвежда голямо количество конкатемерни CpG аналози и пирофосфатни йони (PPi4-), последните от които след това се комбинират с Mg2 + в буфер, за да образуват Mg2PPi. След това аналозите на CpG и Mg2PPi се утаяват до самостоятелно сглобяване в hNV. hNVs лесно се поглъщат в APC, включително дендритни клетки и макрофаги, и задействат имунната активация и съзряване на тези имунни клетки, което води до секреция на провъзпалителни цитокини и повишаване на маркерите за зреене върху клетъчните повърхности. В сравнение с молекулярния CpG, hNVs удължават времето на задържане на тъканите и намаляват страничните ефекти. В модел на миши с меланом, hNVs силно инхибират прогресията на тумора.
Резултати и дискусия
Изграждане и характеризиране на hNV
Размерът на hNVs е лесно регулируем, като просто се контролира времето за реакция (фиг. S1). Както се наблюдава при използване на сканираща електронна микроскопия (SEM), hNVs, образувани от 8-часов RCR, имат среден диаметър от
1 μm (фиг. 2А), което беше потвърдено чрез използване на измервания на динамично разсейване на светлината (DLS) (фиг. 2Б) и микроскопия на атомна сила (AFM) (фиг. S2). Частици с диаметър до 1 μm могат да бъдат ефективно поемани от APC, като макрофаги и дендритни клетки (DC). Всъщност частиците с тези размери са често срещани в неразтворимите алуминиеви соли, най-често срещаните добавки в клиничната употреба 30. Следователно, ние избрахме hNVs, приготвени от 8-часов RCR за по-нататъшно проучване. Използвайки същия метод, GpC, който губи имуностимулираща способност чрез мутиране на двата CG динуклеотида в CpG-1826 в два GC динуклеотида (виж последователностите в таблица S1), бяха включени в GpC ДНК-неорганични хибридни наноцветки (GpC-NFs, фиг. S3 ) като контрола.
Структурна характеристика на hNV. (A) SEM изображения, показващи hNVs, самосглобени от RCR реакция за 8 h. (B) Резултат от DLS, показващ размера на hNV. (C) Схематично описание на етикетирането на hNVs с флуорофори (горен) и изображения на конфокална микроскопия, показващи маркирани с Alexa488 hNVs от RCR реакция за 10 h (по-ниски). (D) EDX графика, показваща профила на елементите на hNV. Вмъкването е списък с тегло на елемента (%) в hNV. Двата пика между Mg-пик и P-пик са от елементи в силициевия субстрат, използван в SEM/EDX.
Висока стабилност на hNVs
Високата стабилност на нановаксините изисква не само съхранението или транспортирането, но и поддържането на ефективността на ваксинацията. Стабилността на hNVs беше оценена като суха формула при висока температура и при третиране на DNase, която е повсеместна в интерстициалната течност, на която често са изложени ваксини или адюванти. По-специално сухият hNV прах се нагрява до 37 ° С, 60 ° С и 80 ° С в продължение на 1 час. Наблюдението на SEM показа, че морфологията на горе-третираните hNVs е почти непокътната (фиг. S7A). Структурната цялост на hNVs предполага висока термична стабилност на hNVs, тъй като както първичната структура (последователност) на ДНК, така и Mg2PPi са силно стабилни при висока температура. Освен това, биостабилността на hNVs е оценена чрез лечение с DNase I, което се очаква грубо да имитира физиологичната среда на интерстициалната течност. 35 SEM резултата (фиг. S7B) показаха, че морфологията на hNVs остава почти непокътната след инкубация при горното третиране за 1 h, което показва високата биостабилност на hNVs в имитираната физиологична среда. Очаква се стабилността на hNVs да поддържа ефикасността на ваксинацията, да увеличи срока на годност на ваксината и да опрости съхранението и транспортирането на ваксината.
Ефективно поемане на hNV от клетките в APC и мощна имуностимулация на APC
Продължително задържане на тумор и намалени странични ефекти на hNVs в сравнение с молекулярния CpG
Фармакокинетично проучване на hNVs, показващо продължително време на задържане на тумор на hNVs в сравнение с молекулярния CpG. (A) Белязаните с IR800 hNVs и CpG (PS гръбначен стълб), съответно, се инжектират в подкожни тумори B16F10 в доза от 1 nmol CpG еквивалент на мишка. Фармакокинетиката на hNV или CpG се проследява в посочените времеви точки чрез оптично изображение. Разликата в интензитета на флуоресценция в CpG група и hNV група в едно и също време се дължи на различно количество инжектиран IR800, когато CpG количествата са еквивалентни в молекулните CpG и hNV (количеството IR800 в CpG е 45 пъти повече от това в hNVs, тъй като в hNVs, един белязан с IR800 праймер е свързан с RCR ДНК продукт, интегриран с 45 CpG еквивалент). На дъното са показани представителни насложени изображения на мишки и флуоресценция. (B) Количествено определяне на нормализираната средна интензивност на флуоресценция в изображения, показани в (A). Данните представляват средна стойност ± s.e.m.
В съответствие с краткото задържане на тъканите, друг недостатък на конвенционалната молекулярна CpG е свързан с множество системни странични ефекти, причинени от CpG, изтичащ в системна циркулация 13, 14 Един от тези странични ефекти е спленомегалия, свързана с екстрамедуларна хематопоеза 14. За да се оцени hNVs за този страничен ефект, hNVs и молекулен CpG се инжектират подкожно на мишки, последвано от определяне на размера и теглото на далаците, за да се оцени спленомегалия. Резултатите разкриват, че hNVs значително намаляват спленомегалията в сравнение с молекулярните аналози на CpG, което ясно показва намаляването на системните странични ефекти от hNVs (фиг. 5). Освен това, H&E оцветяването на далаци при ваксинирани мишки допълнително потвърждава биосъвместимостта на hNV (фиг. S14).
hNVs-медиирана ракова имунотерапия в модел на мишка B16F10 меланом. (А) Туморни обеми на мишки, третирани с PBS, молекулярен CpG, контролен GpC-NFs или hNVs в доза от 2 nmol CpG еквивалент на мишка, чрез интратуморално инжектиране на ден 6 и ден 12 след туморна инокулация. Звездичките представляват значителни разлики между обемите на тумори при мишки, лекувани със съответните различни режими (*** p 5 B16F10 клетки бяха инокулирани подкожно в мишки. На 10-ия ден след инокулацията мишките бяха интратуморно приложени с белязан с IR800 CpG или IR800 белязан hNVs при дозировка от 1 nmole/мишка CpG или CpG еквиваленти в hNVs. Флуоресценцията на получените мишки се записва на Maestro II in vivo образна система (Caliper Life Sciences, Hopkinton, MA) в определени часови точки след инжектирането. интерес (ROI) беше привлечен да включва флуоресцентните региони и средната интензивност на флуоресценция на ROI беше анализирана за количествено определяне.
Ракова имунотерапия
C57BL/6J мишки (лабораторията Jackson) бяха настанени в животно съоръжение при условия, свободни от патогени. Ксенографтен модел B16F10 меланомен тумор е използван за изследване на hNV-базирана имунотерапия. По-конкретно, 5 х 105 клетки B16F10 бяха инокулирани подкожно на мишки. Мишките бяха третирани с определен режим на 5-ия ден и 10-ия ден след инокулацията чрез интратуморално инжектиране на 2 nmole/мишка CpG или еквиваленти (5 мишки/група). Теглото на мишките и размерите на тумора се наблюдават непрекъснато. Обемът на тумора се изчислява по следната формула:
Мишките бяха убити, когато размерите на тумора надвишават 2 cm или когато туморът разви некроза или язва. Цялата работа с животни е извършена в съответствие с Ръководството за грижа и употреба на животните на NIH по протоколи, одобрени от Комитета за грижа и употреба на животните в Клиничния център на NIH. Резултатите бяха анализирани с помощта на GraphPad Prism 4 (La Jolla, CA).
Допълнителен материал
Допълнителна информация
Благодарности
Тази работа беше подкрепена от програма за вътрешни изследвания на Националния институт по биомедицинско изобразяване и биоинженерство (NIBIB), Национални здравни институти (NIH).
- Пациент с рак, който загуби половината от лицето си, го реконструира от пионера хирург The Independent
- Салата за борба с рака с калмари Не само зехтин Средиземноморска диета Рецепти за здравословен дълъг живот
- Превенция на рака Диетата, упражненията и връзката с теглото Cancer UT Southwestern Medical Center
- Управление на страничните ефекти на рака - диета и упражнения
- Непрекъснатият прием на воден екстракт от гъба Chaga (Inonotus obliquus) потиска рака