От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), Университет IZKF в Мюнстер, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), Университет IZKF в Мюнстер, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), IZKF University of Münster, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), Университет IZKF в Мюнстер, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), Университет IZKF в Мюнстер, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), IZKF University of Münster, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), IZKF University of Münster, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), Университет IZKF в Мюнстер, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), Университет IZKF в Мюнстер, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
От Medizinische Klinik I (P-A.A.-L., K.H., C.D., V.J., T.P.), Университет във Вюрцбург, Вюрцбург, Германия; Интегрирана функционална геномика (A.M.M., S.K.), Университет IZKF в Мюнстер, Мюнстер, Германия; Отдел по кардиология (L.N.), Университет в Манчестър, Манчестър, Великобритания; и Schering AG (C.H-H., K.H.F.), Берлин, Германия.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
Естрогените и минералокортикоидите действат върху сърдечно-съдовата система чрез специфични сродни рецептори, минералокортикоидния рецептор (MR) и 2 различни подтипа естрогенни рецептори (ER) и ERα и ERβ. Както ERα, така и ERβ, както и MR, са свързани членове на семейството на ядрените хормонални рецептори, които играят важна роля и могат функционално да си взаимодействат в поддържането на кръвното налягане и в адаптивния отговор на сърдечния мускул към повишено натоварване и нараняване.
Зависимото от лиганда активиране на MR от алдостерон насърчава реабсорбцията на натрий и вода през бъбреците и лигавицата на дебелото черво. Въпреки това, повишените серумни нива на алдостерон в комбинация с диета с високо съдържание на сол или променена експресия на МР насърчават хипертония и сърдечно ремоделиране, включително периваскуларно възпаление, сърдечна фиброза и сърдечна хипертрофия. 1–5 Активиране на MR при пациенти с хронична сърдечна недостатъчност представлява част от неадаптивен отговор, който предизвиква порочен цикъл след сърдечно увреждане. В подкрепа на тази концепция е показано, че MR антагонисти като спиронолактон или еплеренон подобряват симптомите и удължават преживяемостта при пациенти с напреднала хронична сърдечна недостатъчност. 6–8 Наблюдението, че серумните нива на алдостерон корелират положително с хипертрофия на лявата камера и индекса на маса на лявата камера при жените, но не и при мъжете, предполага важни взаимодействия между естрогенната и MR сигнализация. 9,10 Наскоро успяхме да подкрепим тази концепция, като показахме, че неселективният ER агонист 17β-естрадиол предпазва плъховете, третирани с алдостеронова сол (AST), от класически характеристики на MR-медиирано сърдечно-съдово увреждане. 11.
Наблюдението, че атрофията на матката се е появила при ERα-, но не и при ERβ-дефицитни мишки, дава първите доказателства за различни физиологични функции на ERα и ERβ. 12 И двата подтипа ER също са способни да посредничат на излишни функции при увеличаване на генерирането на съдов NO. 13,14 Следователно по-точното разбиране на това как естрогените предпазват от развитието на сърдечно-съдови заболявания зависи пряко от по-подробни познания за конкретни, излишни и в крайна сметка също противоположни функции на двата подтипа ER. 15,16
Разминаващата се роля на двата ER подтипа в различни тъкани насърчава развитието на мощни, изотип-селективни агонисти за ERα и за ERβ, като ERα агонист 16α-LE2 и ERβ агонист 8β-VE2. Тези лиганди са синтезирани въз основа на дискретни разлики в 3D структурата на лиганд-свързващия джоб на ERα и ERβ и осигуряват биологични ефекти, които са в пряка връзка с функцията на ERα и ERβ в репродуктивните органи. 17,18 Тук докладваме, че селективното активиране или на ERα, или на ERβ чрез специфични за изотипа агонисти предпазва сърцето на гризачите срещу хипертония, предизвикана от лечението с алдостеронова сол, съдово възпаление и сърдечна хипертрофия. Също така докладваме за идентифицирането на протеини, които са диференцирано експресирани в сърцето в отговор на активирането на MR, ERα и ERβ.
Методи
Лечение на животни
Хемодинамични измервания
Проведени са инвазивни хемодинамични измервания, както е описано преди, при лека анестезия на изофлуран и спонтанно дишане. 19 Телесното тегло, теглото на сърцето, теглото на матката и теглото на бъбреците се определят след хемодинамичен анализ. Относителното тегло на сърцето се изчислява от абсолютното тегло на сърцето и дължината на пищяла. 20 Серумните нива на естрадиол и ангиотензин II се определят чрез радио имуноанализи в съответствие с инструкциите на производителя (естрадиол: DPC-Biermann; ангиотензин II: полуостров).
Морфометрия
Периваскуларното натрупване на колаген беше количествено определено при всяко животно около ≥6 отделни коронарни артерии в 3 непоследователни секции (общо измервания: 972 артерии), а площите на напречното сечение на сърдечните миоцити бяха определени при всички плъхове (общо: 4320 миоцити) съгласно публикуваните протоколи . 11 Площите на напречното сечение на средата на гръдната аорта са изчислени чрез ръчно проследяване на вътрешната еластична ламина и външната граница на средата с помощта на софтуера Image J в ≥3 независими секции от ≥3 проби от всяко животно (общо измервания: 175 аорти ). 11.
Имунохистохимия
Аортните разрези бяха оцветени за остеопонтин съгласно публикуваните протоколи. 11 Всеки слайд беше сравнен със съседен участък, в който бяха пропуснати първични антитела. Имунооцветяването за остеопонтин се определя количествено с помощта на софтуера Scion. Анализирани са поне 3 секции на образец с 3 зрителни полета на секция при ≥4 животни на група (общо измервания: 216 секции).
2D гел електрофореза и анализ на протеини
Протеиновите екстракти от лявата камера бяха подложени на 2D гел електрофореза, а събирането на изображения и анализът на данните бяха извършени в съответствие с общите протоколи на Amersham. Три екстракта, които бяха маркирани диференциално с флуоресцентни багрила, съдържащи Cy1, Cy2 или Cy3, бяха заредени и анализирани едновременно върху един гел (1: вътрешен стандарт, Cy2; 2: овариектомизиран плъх [ovx] - AST - плацебо, Cy3; и 3: едно от следните: ovx − AST − 17β-естрадиол, ovx − AST − 16α-LE2 или ovx − AST − 8β-VE2 = Cy5). Схемите на експресия на протеини бяха определени при 3 животни на група и интензитетите на петна бяха сравнени с вътрешната референтна група (ovx − AST − плацебо), при която интензитетът на петна беше зададен на ± 1. Протеиновите петна бяха изрязани от препаративни гелове и пептидно картографиране чрез матрична асистирана лазерна десорбционна йонизация-време на полет беше извършено на инструмент TofSpec 2E. Пептидното секвениране се извършва на анализатор на масата на йонни капани Esquire3000 (Bruker Daltonics). Данните за отпечатъци от пептидни маси и данни от последователността бяха подложени на търсене в база данни (SwissProt, Швейцарски институт по биоинформатика) с помощта на търсачката Mascot (Matrix Science LTD). По-подробно техническо описание е налично в допълнителните онлайн данни.
Статистика
Резултатите показват средна стойност ± SEM. Мултигруповите сравнения бяха направени чрез еднопосочно ANOVA, последвано от post-hoc тестване на Student-Newman-Keuls с двойно тестване, използвайки софтуера SigmaStat 2.03, и P 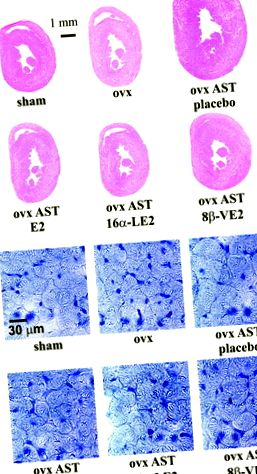
Фигура 1. A, Сърдечни сечения (хематоксилин/еозин) илюстрират повишена сърдечна маса при плъхове AST (ovx AST плацебо) в сравнение с плъхове или овце, подложени на фалшива операция, които са отслабени при лечение с агонист ERα 16α-LE2, агонист ERβ 8β-VE2 и неселективния агонист на ER 17β-естрадиол (Е2). B, Увеличени сърдечни области на напречно сечение на миоцити при плъхове AST с изчерпани естроген (ovx AST плацебо) намаляват при лечение с ERα агонист 16α-LE2, ERβ агонист 8β-VE2 или неселективен ER агонист 17β-естрадиол (оцветяване с хематоксилин).
ТАБЛИЦА 1. Сърдечна морфометрия и глобални и хемодинамични измервания
Глобални измервания
Телесната маса се увеличава при овариектомизирани в сравнение с непокътнати плъхове и не се променя при лечение с алдостерон-сол (Таблица 1). Селективният ERα агонист 16α-LE2 и неселективният ER агонист 17β-естрадиол, но не и ERβ агонистът 8β-VE2 атенюират мастния фенотип на изчерпани с естроген плъхове. Теглото на матката и серумните нива на естрадиол са намалени при овце плъхове. Атрофията на матката се предотвратява от 17β-естрадиол и от 16α-LE2, но не и от ERβ агониста 8β-VE2. Серумните нива на естрадиол са по-ниски при овариектомизирани в сравнение с плъхове, подложени на фалшиво опериране и се връщат към физиологичните нива при животни, получаващи инжекции със 17β-естрадиол. Серумните нива на ангиотензин II бяха потиснати в сравнима степен при всички животни, получаващи лечение с AST (Таблица 1).
Съдово ремоделиране и генна експресия
Хроничното лечение с алдостерон-сол е довело до удебеляване на аортната среда (Фигура 2А и 2В), периваскуларна фиброза на коронарните артерии (Фигура 2С и 2D) и по-високи нива на експресия на остеопонтин в аортната среда в сравнение с плъхове или овце, подложени на фалшива операция 2F). Лечение на AST плъхове с ERα агонист 16α-LE2, ERβ агонист 8β-VE2 или 17β-естрадиол атенюира хипертрофия на аортната среда, фиброза и експресия на остеопонтин (Фигура 2А до 2F). Експресията на сърдечни ERa и ERβ протеини и нивата на MR mRNA не се различават сред всички групи на лечение (вж. Допълнителни онлайн данни).
Фигура 2. A, Хипертрофията на медиите при плъхове AST се отслабва чрез съвместно лечение с ERα агонист 16α-LE2 и ERβ агонисти 8β-VE2 и 17β-естрадиол (E2). B, Представителни аортни сечения (хематоксилин/еозин), илюстриращи дебелината на средата. С, Перуваскуларното натрупване на колаген около коронарните артерии на AST плъхове е отслабено чрез лечение с ERα агонист 16α-LE2 и ERβ агонист 8β-VE2 и 17β-естрадиол (E2). D, Представителни напречни сечения на коронарните артерии, илюстриращи периваскуларно натрупване на колаген. E, Повишената експресия на аортен остепонтин при плъхове, лекувани с алдостерон, е отслабена чрез съвместно лечение с 16α-LE2, 8β-VE2 и 17β-естрадиол (E2). F, представителни аортни напречни сечения, оцветени за остеопонтин, илюстрират преобладаващата клетъчна локализация на остеопонтин в съдовите гладкомускулни клетки. Лентите показват средната стойност ± SEM (n = 9 до 10 животни на група; *P
Анализи на сърдечни протеоми
Средно бяха открити ≈1400 отделни протеинови петна чрез 2D гел електрофореза на нефракционирани сърдечни екстракти (Фигура 3А). Лечението на AST плъхове с ERα агонист 16α-LE2, ERβ агонист 8β-VE2 или неселективен ER агонист 17β-естрадиол променя нивата на експресия на специфични протеини, участващи в сърдечната контрактилитет (α-миозин тежка верига [α-MHC]), трансдукция на сигнала (неврабин II), енергиен метаболизъм (АТФ-синтаза а-верига), реакция на клетъчен стрес и образуване на извънклетъчна матрица (фибромодулин; Таблица 2 и Фигура 3В), докато лактат дехидрогеназа-2, малат дехидрогеназа, сърдечна а-актин и намалената експресия на никотинамид-аденин динуклеотид-убихинон оксидоредуктаза не се повлияват значително от лечението с естроген. Уестърн блотинг експериментите потвърждават наблюдението, че 17β-естрадиол, 16α-LE2 и 8β-VE2 намаляват повишената експресия на сърдечен неврабин II при плъхове AST (вж. Допълнителни данни).
Фигура 3. A, Представителни гелове за 2D гел за електрофореза на сърдечни екстракти от яйцеклетка и животно, получаващи допълнително лечение с алдостерон-сол (ovx AST плацебо) илюстрират модела на протеинови петна, получен чрез 2D гел електрофореза. Номерирането на петна се отнася до Таблица 2. B, Представителни микрофотографии на протеинови петна, които показват различна интензивност сред плъхове от различни третирани групи. Понижаването на регулирането на фибромодулина при плъхове AST се отслабва от 17β-естрадиол (Е2) и ERβ агонист 8β-VE2. Повишената експресия на неврабин II при плъхове AST се отслабва от 17β-естрадиол, 16α-LE2 и 8β-VE2. Намалената експресия на АТР-синтаза α-верига при AST плъхове е възстановена от 17β-естрадиол и от 8β-VE2, но остава ниска при AST плъхове, получаващи ERα агонист 16α-LE2 (n = 3 животни на група).
ТАБЛИЦА 2. Анализ на сърдечния протеом
Дискусия
Основните открития на това проучване могат да бъдат обобщени, както следва: Първо, активирането или на ERα, или на ERβ предпазва женските плъхове AST срещу хипертония, сърдечна хипертрофия, съдова фиброза и повишена експресия на остеопонтин. Второ, ефикасността на ERα за модулиране на кръвното налягане варира значително при различните животински модели. Трето, лечението с алдостерон-сол дава специфични промени на сърдечния протеом, които са частично и диференцирано обърнати при лечение с ERα или ERβ селективни агонисти.
Хроничното лечение с алдостерон-сол насърчава обширно съдово ремоделиране при плъхове AST, което е свързано с повишена експресия на съдови остеопонтини. 11,21 Трябва да се отбележи, че остеопонтин не само служи като маркер на съдово възпаление, но също така играе функционална роля при ремоделиране на съдовете, тъй като мишките с дефицит на остеопонтин са устойчиви на индуцирана от алдостерон сърдечна фиброза. 24 Интересното е, че 17β-естрадиол е показал, че директно отслабва експресията на остеопонтин в съдовите гладкомускулни клетки. 25 Заедно тези данни предполагат, че защитните функции на 16α-LE2, 8β-VE2 и 17β-естрадиол при ремоделиране на съдовете и върху експресията на съдови остеопонтини са функционално свързани процеси.
Сърдечната хипертрофия е често срещана последица от хипертонията и независим предиктор за сърдечно-съдовата смъртност. 26 Съобщава се, че и двата подтипа ER намаляват сърдечната хипертрофия в генетични модели на мишки или във фармакологични проучвания. 19,27,28 За разлика от предишни проучвания при спонтанни хипертонични плъхове, които не разкриват понижаващ кръвното налягане ефект на 16α-LE2, антихипертрофичните ефекти на 16α-LE2 (и на 8β-VE2) при плъхове AST са най-вероятни обяснено с по-ниски нива на кръвното налягане, въпреки че не можем официално да изключим наличието на допълнителни и директни хормонални ефекти върху миокарда. По-малки сърдечни области на напречното сечение на миоцитите при плъхове AST, получаващи лечение с ERα или ERβ селективен агонист, подкрепят това тълкуване и показват, че благоприятни естрогенни ефекти могат да бъдат постигнати от ERβ лиганд, който не стимулира растежа на матката.
Въпреки че сърдечната хипертрофия е била атенюирана от ERα и ERβ селективни агонисти, само активирането на ERα или от 16α-LE2, или от 17β-естрадиол и, за отбелязване, не активирането на ERβ от 8β-VE2, е предотвратило понижаването на регулацията на сърдечния α-MHC експресия при овариектомирани AST плъхове. Тези наблюдения подкрепят хипотезата, че естрогените намаляват регулирането на сърдечната експресия на α-MHC, което многократно се наблюдава при изчерпани с естроген плъхове чрез активиране на ERα, но не и на ERβ рецептора. 19,29
За разлика от α-MHC, активирането на ERα и на ERβ намалява повишените нива на експресия на скелета протеин неврабин II, който е насочен към протеин фосфатаза I към актиновия цитоскелет при плъхове AST. 30,31 Подобреното насочване на сърдечната протеинова фосфатаза I може да бъде функционално значимо, тъй като трансгенните мишки, свръхекспресиращи протеинова фосфатаза I, развиват дилативен синдром, подобен на кардиомиопатия. 32
За разлика от α-MHC и неврабин II, само от ERβ агониста 8β-VE2 и 17β-естрадиол, но, забележете, не ERα агонистът 16α-LE2 предотвратява понижаването на регулацията на АТР синтазата α-верига и на фибромодулин при AST плъхове . Експресията и функцията на фибромодулин досега не са изследвани в сърцето, въпреки че един-единствен доклад показва повишена експресия на този протеин в сърдечния миксома. 33 Независимо от това, възможно е фибромодулинът да играе роля в узряването на сърдечния колагенов матрикс, тъй като мишките с дефицит на фибромодулин проявяват екстремна слабост на сухожилията и излишък от незрели колагенови фибрили, наподобяващи синдрома на Ehlers-Danlos. 34
И накрая, редица протеини, участващи в сърдечния метаболизъм, реакцията на стрес и клетъчната структура и структурата на саркомера, включително лактат дехидрогеназа-2, малат дехидрогеназа, лактат дехидрогеназа β-верига, сърдечен α-актин и намален никотинамид-аденин динуклеотид-убихинон оксидоредуктан показаха диференциални модели на експресия при плъхове с AST, които не реагираха на лечение с естроген и следователно е малко вероятно да повлияят на сърдечния фенотип на лекувани с естроген плъхове AST.
Перспективи
Клиничните и експериментални данни предполагат важни взаимодействия между минералокортикоидите и ER функцията при сърдечно-съдови увреждания. Този доклад показва, че и двата подтипа ER притежават излишни функции за защита на сърдечно-съдовата система срещу вредните ефекти от лечението с алдостерон-сол. Нефеминизиращите ERβ агонисти имат терапевтичен потенциал за лечение на хипертонично сърдечно заболяване, което заслужава допълнителна оценка.
- 10 начина за увеличаване на естествения естроген тридесетте
- 10 пациенти, 10 години - Дългосрочно проследяване на сърдечно-съдови рискови фактори при дефицит на Glut1
- Поредица от полезни изследователски инструменти за затлъстяването, основният рисков фактор за сърдечно-съдови заболявания -
- Асоциация между затлъстяването, предсърдното мъждене и разпространението на сърдечно-съдови заболявания -
- Атерогенен индекс на плазмата и нейната връзка с рисковите фактори за сърдечно-съдови заболявания сред
