Катедра по медицина, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния;
Ветерани по въпросите на здравеопазването в Сан Диего, Сан Диего, Калифорния;
Катедра по медицина, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния;
Ветерани по въпросите на здравеопазването в Сан Диего, Сан Диего, Калифорния;
Ветерани по въпросите на здравеопазването в Сан Диего, Сан Диего, Калифорния;
Boehringer Ingelheim, Biberach an der Riss, Германия;
Lexicon Pharmaceuticals, Incorporated, The Woodlands, Тексас; и
Lexicon Pharmaceuticals, Incorporated, The Woodlands, Тексас; и
Катедра по медицина, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния;
Ветерани по въпросите на здравеопазването в Сан Диего, Сан Диего, Калифорния;
Катедра по молекулярна физиология на растенията и биофизика, Институт "Юлиус-фон-Сакс", Университет във Вюрцбург, Вюрцбург, Германия
Катедра по медицина, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния;
Катедра по фармакология, Калифорнийски университет, Сан Диего, Ла Хола, Калифорния;
Ветерани по въпросите на здравеопазването в Сан Диего, Сан Диего, Калифорния;
Адрес за заявки за препечатка и друга кореспонденция: V. Vallon, Div. по нефрология и хипертония, кат. по медицина и фармакология, Калифорнийски университет, Сан Диего, и VA San Diego Health System, 3350 La Jolla Village Dr., San Diego, CA 92161 (e-mail: [email protected]).
Резюме
За да определим дали SGLT1 и SGLT2 отчитат цялата реабсорбция на глюкоза в бъбреците и дали увеличаването на медиирания от SGLT1 транспорт напълно обяснява ограничения глюкозуричен отговор на инхибирането на SGLT2 при евгликемия, използвахме фармакологично инхибиране на SGLT2 в присъствието и липсата на SGLT1 в мишки и сравниха реабсорбция на бъбречна глюкоза с мишки без липса на SGLT1 и SGLT2 (Sglt1/Sglt2 -/-). Тези проучвания също така дават представа за въпроса дали фармакологичните инхибитори на SGLT2 достигат SGLT2 в ранния проксимален тубул при достатъчно високи концентрации, за да инхибират напълно in vivo SGLT2.
Животни.
Всички експерименти с животни бяха проведени в съответствие с Ръководство за грижа и употреба на лабораторни животни (Национални здравни институти, Bethesda, MD) и беше одобрен от местния институционален комитет за грижи и употреба на животните. Използвани са Sglt1 -/- или Sglt1/Sglt2 -/- мишки и са сравнени с WT мишки, съвпадащи по възраст и пол (3, 17). Всички мишки са били хранени с диета с ниско съдържание на глюкоза (в%: 52,5 протеин, 11,3 мазнини, 19,9 фибри, 6,2 пепел, 0,9 нишесте, 0,3 захар, 13,8 MJ ME/kg; ssniff Spezialdiäten, Soest, Германия) за предотвратяване на малабсорбция на глюкоза/галактоза и последваща диария поради липса на SGLT1. Мишките бяха настанени в същата стая за животни с 12: 12-часов цикъл светлина-тъмнина и свободен достъп до чешмяна вода.
Остри и хронични глюкозурични отговори на селективно инхибиране на SGLT2 при мишки Sglt1 -/- и WT.
Емпаглифлозин е селективен SGLT2 инхибитор с IC50 от 3,1 nM за човешки SGLT2 и 1,9 nM за миши SGLT2, силно селективен за SGLT2 над SGLT1 при хора (> 2500 пъти) и мишки (∼ 5800 пъти), съответно (4) и се използва като фармакологично средство за инхибиране на SGLT2. Empagliflozin се доставя от Boehringer Ingelheim, Biberach, Германия. Бяха проведени следните три серии изследвания.
Първо, WT и Sglt1 -/- мишките бяха третирани чрез орален сонда с носител или емпаглифлозин (0,1–30 mg/kg) заедно с водно натоварване (30 μl/g телесно тегло), за да се улесни последващото количествено събиране на урина в метаболитни клетки над 3 з.
Второ, мишките са лекувани с емпаглифлозин (300 mg/kg диета) в продължение на 3 седмици, докато се измерват телесното тегло, съотношенията глюкоза/креатинин в урината, нивата на глюкоза в кръвта и приемът на храна и течности. Приемът на храна и течности се определя, докато мишките се държат в редовните си клетки. Урината се получава по едно и също време на деня, като се вземат мишките за предизвикване на рефлекторно уриниране и се държат над чиста петриева чиния за събиране на проби. За сдвоени измервания на глюкозата кръвта се събира чрез изрязване на опашката веднага след събирането на урина при будни мишки.
Трето, след 3 седмици лечение с емпаглифлозин в диетата, както е описано по-горе, са проведени проучвания за клирънс на инулин за определяне на скоростта на гломерулна филтрация (GFR), филтрирана глюкоза, екскреция на глюкоза в урината (UGE) и FGR при терминална анестезия, както е описано по-горе, 17). Накратко, мишките бяха анестезирани с тиобутабарбитал (100 mg/kg ip, 2 μl/g телесно тегло; Sigma-Aldrich, Сейнт Луис, Мисури) и кетамин (100 mg/kg im, 2 μl/g телесно тегло; Butler, Дъблин, ОН). Вратната вена се канюлира за непрекъсната инфузия на 2,25% говежди серумен албумин в 0,85% NaCl при скорост от 0,4 ml · h -1 · 30 -1 g телесно тегло. За оценка на GFR на два бъбрека чрез инулинов клирънс, [3 H] инулин се добавя към инфузията, за да се доставят 5 μCi · h -1 - 30 -1 g телесно тегло Екскрецията на глюкоза и [3 H] инулин с урината се оценява чрез количествено събиране на урина чрез катетър на пикочния мехур за 30-минутни периоди. Кръвни проби (50 μl) се взимат по средата на всеки период от артериален катетър, който също се използва за наблюдение на кръвното налягане и сърдечната честота. Концентрациите на [3 H] инулин в плазмата и урината бяха измерени чрез течно сцинтилационно броене.
Проучвания за бъбречен клирънс при мишки без Sglt1/Sglt2.
Проведени са проучвания за бъбречен клирънс при терминална анестезия, следвайки описаните по-горе процедури.
Анализ на кръв и урина.
Кръвната глюкоза при будни мишки се определя с помощта на глюкометър Ascensia Elite XL (Bayer, Mishawaka, IN). Плазмената глюкоза при проучвания за клирънс и цялата глюкоза в урината се определят по метода на хексокиназа/глюкоза-6-фосфат дехидрогеназа (Infinity, Thermo Electron, Louisville, CO). Общите концентрации на емпаглифлозин в плазмата се определят чрез течна хроматография-тандемна масспектрометрия. Установихме, че средното фракционно свързване на белтъка на емпаглифлозин в плазмата на мишката е постоянно в широк диапазон (до> 50 μM) при 88,1 ± 0,5%. Използвахме последната информация за изчисляване на свободните плазмени концентрации.
Статистически анализ.
Данните са показани като средни стойности ± SE. ANOVA и сдвоени или несдвоени ученически т-бяха проведени тестове за анализ на статистически разлики в сдвоените набори от данни и между групите, съответно. P 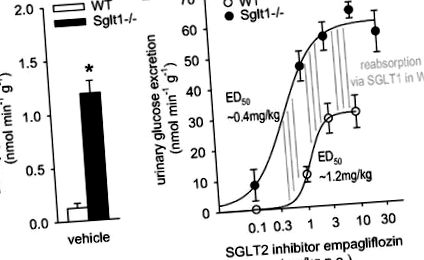
Фиг. 1.Максималният остър глюкозуричен отговор на натриево-глюкозния котранспортер SGLT2 инхибитор се засилва двукратно при Sglt1 -/- спрямо мишки от див тип (WT) при проучвания на метаболитни клетки. A: екскрецията на глюкоза в урината (UGE) е по-голяма при Sglt1 -/- в сравнение с WT мишки след приложение на носител. Б.: емпаглифлозин в зависимост от дозата увеличава UGE в WT. Моля, обърнете внимание на различен мащаб от у-ос срещу. A. В сравнение с WT, индуцираният от емпаглифлозин UGE се измества наляво и максималният отговор се удвоява при мишки Sglt1 -/-. Разликата между кривите доза-отговор, която отразява реабсорбцията на глюкоза, медиирана чрез SGLT1 при WT мишки, достига максимум при доза от ∼0,4 mg/kg (посочена на наляво от вертикалните линии) и се поддържа (всички вертикални линии имат еднаква дължина) за по-високи дози до 10 mg/kg, което показва висока селективност на инхибитора SGLT2 спрямо SGLT1 в този дозов диапазон. Имайте предвид, че емпаглифлозин започна да увеличава екскрецията на глюкоза в WT, когато реабсорбцията чрез SGLT1 достигна своя максимум; н = 4-8/доза и генотип. *P
Хроничният глюкозуричен ефект на инхибитора на SGLT2 се засилва 1,5 до 2 пъти при Sglt1 -/- спрямо WT мишки, свързан с по-голямо увеличение на приема на храна и течности.
Лечението с емпаглифлозин (300 mg/kg диета) предизвика бързо (в рамките на първия ден) повишаване на съотношенията глюкоза/креатинин в урината до 1,5- до 2 пъти по-високи нива при Sglt1 -/- спрямо WT мишки, които продължават да продължителност на лечението (3 седмици) (фиг. 2A). Свързаното намаляване на кръвната глюкоза се засилва при Sglt1 -/- спрямо WT мишки след 24 часа (-33 ± 5 срещу -11 ± 5%; P
Фиг. 2.Хроничният глюкозуричен отговор на инхибитора на SGLT2 се засилва 1,5 до 2 пъти при Sglt1 -/- спрямо WT мишки, свързан с по-голямо увеличение на приема на храна и течности. Изобразени са ефектите от приложението на емпаглифлозин (300 mg/kg диета) за 3 седмици върху съотношенията глюкоза/креатинин в урината (A), абсолютни нива и промени в кръвната глюкоза (Б.) и промени в приема на храна (° С), прием на течности (д) и телесно тегло (Е.). Направени са спонтанни събиране на урина и кръв се събира чрез изрязване на опашка при будни мишки; приемът на храна и течности се измерва в обикновени клетки; н = 9–11/група. *P
Инхибиторът на SGLT2 намалява бъбречния FGR до 44% в WT и елиминира изцяло реабсорбцията на глюкоза при Sglt1 -/- мишки.
След 3 седмици лечение с емпаглифлозин в диетата (вж. По-горе), изследването на бъбречната глюкоза беше изследвано под терминална анестезия късно сутринта. Филтрираната глюкоза се изчислява като продукт на плазмената глюкоза и клирънс на [3 H] инулин и се сравнява с екскрецията на глюкоза. Фигура 3 изобразява връзката между филтрираната глюкоза и абсолютната екскреция на глюкоза през бъбреците (Фиг. 3A), абсолютна реабсорбция на бъбречна глюкоза (Фиг. 3Б.) и FGR (фиг. 3° С) и при двата генотипа. Хронично лечение с SGLT2 инхибитор емпаглифлозин в диетата установява стойности за FGR от 64 ± 2% при WT и 17 ± 2% при Sglt1 -/- мишки (P
Комбинираният генен нокаут на Sglt1 и Sglt2 напълно предотвратява реабсорбцията на бъбречната глюкоза.
Спонтанното събиране на урина и кръв разкрива, че абсолютните концентрации на глюкоза в урината и съотношенията глюкоза/креатинин в урината са повишени, докато нивата на глюкоза в кръвта са намалени при Sglt1/2 -/- спрямо WT мишки (Таблица 1) Загубата на глюкоза и калории в урината при Sglt1/2 -/- мишки се свързва с по-ниско телесно тегло и по-голям прием на храна и течности в сравнение с WT мишки. Увеличението на приема на храна и съобщените по-рано по-ниски серумни нива на инсулин (12) могат да допринесат за единственото умерено намаляване на телесното тегло и нивата на кръвната глюкоза при Sglt1/2 -/- мишки. По-високите стойности за хематокрит, плазмените концентрации на натрий и алдостерон, както и съотношенията вазопресин/креатинин в урината предоставят косвени доказателства за хемоконцентрация при Sglt1/2 -/- в сравнение с WT мишки (Таблица 1).
Таблица 1. Параметри на плазмата и урината при мишки с дефицит както на SGLT2, така и на SGLT1
Стойностите са средни стойности ± SE; н = 9/група. WT, див тип; SGLT, котранспортер на натрий-глюкоза. Скобите показват концентрацията.
# P
Фиг. 4.Комбинираният генен нокаут на Sglt1 и Sglt2 напълно предотвратява реабсорбцията на бъбречната глюкоза. Проучванията за клирънс на инулин са извършени под терминална анестезия. Изобразена е връзката между филтрирана глюкоза и абсолютна бъбречна екскреция на глюкоза (A), абсолютна реабсорбция на бъбречна глюкоза (Б.) и фракционна реабсорбция на бъбречна глюкоза (° С) при мъжки и женски Sglt1/Sglt2 мишки с двойно нокаутиране. Всяка точка представлява 1 период на експеримент за изчистване. В A и Б., линията на идентичност е включена като пунктирана линия за по-лесно тълкуване. SGLT2 и SGLT1 обясняват реабсорбцията на бъбречната глюкоза. Стойностите, очаквани за WT нетретирани мишки, са показани за сравнение (вж. Легендата за фиг. 3 за подробности).
Основните констатации на настоящото проучване са, че SGLT2 и SGLT1 заедно могат да отчетат цялата реабсорбция на глюкоза в бъбреците на еугликемични мишки. Последователни доказателства се предоставят от фармакологични проучвания и проучвания за нокаут на гени. Като се вземат предвид представените данни, заедно с публикувани резултати за Sglt1 -/- и Sglt2 -/- мишки (3, 17), ние предлагаме, че в бъбреците на нелекувани недиабетни мишки, 97 и 3% от филтрираната глюкоза се реабсорбират съответно чрез SGLT2 и SGLT1, съответно . По време на инхибирането на SGLT2, натоварването с глюкоза към експресиращите SGLT1 сегменти S2/S3 на проксималния тубул се засилва и настъпва компенсаторно увеличение на медиирания от SGLT1 транспорт. Това обяснява защо FGR се поддържа на 40-50% в отговор на инхибитор на SGLT2 при евгликемични условия.
В обобщение, ние за първи път показваме, че SGLT2 и SGLT1 заедно могат да обяснят реабсорбцията на бъбречна глюкоза при еугликемични мишки. Като се вземат предвид представените данни, заедно с публикувани резултати за Sglt1 -/- и Sglt2 -/- мишки (3, 17), заключаваме, че в бъбреците на нелекувани мишки с евгликемия 97 и 3% от филтрираната глюкоза се реабсорбират съответно чрез SGLT2 и SGLT1, съответно . По време на генетично или фармакологично инхибиране на SGLT2 се получава компенсаторно увеличение на SGLT1-медиирания транспорт, което обяснява защо бъбречната FGR се поддържа на 40-50%. Проучванията също така предоставят доказателства, че инхибиторът на SGLT2 емпаглифлозин може да достигне и инхибира в бъбреците всички SGLT2, които допринасят за реабсорбцията на глюкоза.
Авторите са подкрепени от Националните институти по здравни помощи R01DK56248, R01HL94728, Центъра за остра бъбречна травма UAB/UCSD O'Brien NIH-P30DK079337 (на V. Vallon и S. C. Thomson, включително пилот и възможност за осъществимост на T. Rieg); Американската сърдечна асоциация (Научен грант за развитие 10SDG2610034 на Т. Риг); грант на Carl W. Gottschalk за изследване на Американското общество по нефрология на T. Rieg; стипендия на фондацията за диабет в Манпей Сузуки за Т. Масуда; департаментът по въпросите на ветераните; и от Boehringer Ingelheim (към V. Vallon).
В. Валон получи през последните 12 месеца безвъзмездна помощ за основни научни изследвания от Boehringer Ingelheim и Amylin. E. Mayoux е нает от Boehringer Ingelheim. К. Плат и Д. Р. Пауъл са наети от Lexicon.
- Измерване на глюкоза без иглени убождания Преглед на храненето
- Как да увеличим енергията, докато отслабваме Клиника Линдора
- Как да увеличите изгарянето на калории и мазнини върху елиптичната (безплатна електронна книга) - HOLOFIT от Holodia
- Как да увеличим кърмата чрез добавяне на галактагога
- Как да увеличите пресата си с 10 кг за 3 седмици - Смолов-младши
