Шао-Джи Уанг
1 Катедра по съвместна хирургия и спортна медицина, болница Zhongshan на университета Ксиамен, Ксиамен, Китай
Джи-Джън Чин
1 Катедра по съвместна хирургия и спортна медицина, болница Zhongshan на университета Ксиамен, Ксиамен, Китай
Тонг-ен Джанг
2 Медицински факултет на Университета Ксиамен, Ксиамен, Китай
Чун Ся
1 Катедра по съвместна хирургия и спортна медицина, болница Zhongshan на университета Ксиамен, Ксиамен, Китай
Свързани данни
Суровите данни, подкрепящи заключенията на този ръкопис, ще бъдат предоставени от авторите, без излишни резерви, на всеки квалифициран изследовател.
Резюме
Въведение
Артрозата (ОА) е често срещана дегенеративна патология на ставите, засягаща 151 милиона души по целия свят. Директните вътреставно инжектиране на лекарства обикновено се използват за подобряване на бионаличността на ставите, като същевременно минимизират системните усложнения. Напоследък се съобщава за малка молекула, картогенин (KGN), която насърчава синтеза на колаген (Johnson, 2012). Съобщава се, че вътреставно инжектиране на KGN подобрява регенерацията на хрущяла (Kang et al., 2014; Mohan et al., 2016; Fan et al., 2018). KGN обаче не може да осигури дългосрочни терапевтични ефекти поради бързото изчистване и краткото задържане на KGN в ставите, което създава недостатък в клиничното му приложение. За да се подобри времето за престой на лечебните агенти в ставите, изследователите са използвали хидрогелове за доставяне на лекарства и освобождаване на лекарството за контрол (Seliktar, 2012).
Поли (лактид-ко-гликолид) –поли (етилен гликол) -поли (лактид-ко-гликолид) (PLGA – PEG – PLGA) триблок кополимер е използван като потенциална матрица на термогел и може да се разтваря във вода при ниска температура (напр. 4 ° C) и разтворът се гелира около телесната температура (т.е. 37 ° C) (Yu et al., 2011; Li et al., 2012; Wang et al., 2016c, 2019; Zhang et al., 2019). Като се имат предвид предимствата на притежаването и минимално инвазивния начин за доставяне на биоактивни молекули, в настоящото проучване ние използвахме PLGA – PEG – PLGA кополимер за производството на термогел, вграден с терапевтична концентрация на KGN за вътреставно инжектиране. Системата KGN термогел беше оценена както in vitro, така и in vivo, за да се изследва потенциалът за лечение на ОА. Ние култивирахме хондроцити, предварително обработени с IL-1β, за да имитират OA хондроцити (Cui et al., 2016), за да изследват ефекта на KGN термогела върху OA хондроцитите по отношение на производството и разграждането на хрущялната матрица. След това PLGA – PEG – PLGA термогелът със или без KGN се инжектира в OA колена при зайци, за да се изследват ефектите на KGN термогела върху OA.
Материали и методи
Подготовка на PLGA – PEG – PLGA термогел
Триблокните кополимери PLGA – PEG – PLGA са закупени от (Daigang Co., Ltd., Jinan, Shandong, China). Съполимерите са синтезирани чрез полимеризация с отваряне на пръстена (ROP) на L-LA и GA с PEG като макроинициатор и Sn (Oct) 2 като катализатор, както беше съобщено по-рано (Wang et al., 2016c). Mns на PEG и PLGA са съответно 1500 и 1400 g/mol. Моларното съотношение на L-LA и GA в PLGA сегмента е 75:25. PLGA – PEG – PLGA триблок-кополимерите се разтварят в PBS (рН 7.4), за да се получи 20 тегловни% разтвор на гел, който след това се поддържа при 4 ° C, преди да се използва в следващите експерименти. Поведението на зол-гел при преход на PLGA-PEG-PLGA термогел беше потвърдено чрез инкубация при 37 ° C за 15 минути.
Приготвяне на KGN Thermogel
Десет милиграма KGN (Selleck Chemicals, Шанхай, Китай) се разтварят в 0,6 ml диметилсулфоксид (DMSO) и след това се разреждат с PBS (рН 7,4), за да се получат 5 mM KGN работни разтвори. KGN термогелът се приготвя чрез смесване на 100 μl 5 mM KGN разтвор с 10 ml PLGA-PEG-PLGA гел разтвор, за да се получи KGN гел разтвор, съдържащ 50 μM KGN. PLGA-PEG-PLGA гел разтвор без KGN беше използван като контрол.
Издаване на KGN ин витро
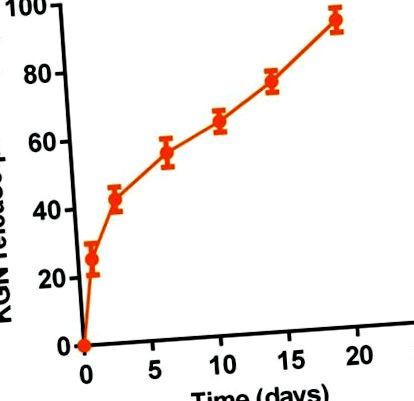
In vitro непрекъснатото освобождаване на KGN от KGN термогела се определя чрез ултра-микро UV спектрофотометър (Nanodrop 2000). Накратко, 1 ml 20 тегловни% разтвор на термогел или KGN термогел се поставят във флакон с вътрешен диаметър 16 mm за желиране при 37 ° С. След това 2 ml PBS се добавят върху гела. Супернатантата се събира през зададени интервали от време (0.0, 1.0, 3.0, 7.0, 11.0, 15.0 и 20.0 дни). След това бяха заменени още 2 ml PBS. Серийните концентрации на KGN в разтвор на PBS бяха използвани като стандарти. Измерването се извършва с дължина на вълната на детектиране 277 nm. Количеството освободен KGN във всеки момент от време се изчислява като процент от общото съдържание на KGN на 1 ml 20 тегловни% термогел или разтвор на KGN термогел.
Изолиране и култура на хондроцити
Двумесечни възрастни новозеландски бели зайци с тегло около 1,5 kg бяха жертвани за изолиране на хондроцити, както беше споменато по-рано (Wang et al., 2016a). Първичните хондроцити са събрани от хрущяла на коленете и раменете. Първо, смленият хрущял се смила в продължение на 6 часа в 10 ml 0,2% w/v колагеназа тип 2 (Gibco BRL Co. Ltd.) при 37 ° С. Получената клетъчна суспензия се центрофугира и ресуспендира в DMEM с ниско съдържание на глюкоза, допълнена с 10% FBS (HyClone ™, Thermo Scientific, Австралия) и 1% пеницилин и стрептомицин. Изолираните хондроцити се култивират в еднослойни култури в овлажнен инкубатор при 37 ° С, 5% СО2 и 21% О2. Пасаж 2 хондроцити бяха използвани за последващ експеримент.
Хондроцити, третирани с IL-1β
Прилепнали заешки хондроцити в пасаж 2, достигащи 60–70% сливане, се култивират със серумно гладна среда (DMEM/F12, допълнена с 1% FBS) в продължение на 12 часа и след това се третират с IL-1β (10 ng/ml) в продължение на 2 часа за следните ин витро експерименти.
Дизайн на заешко коляно OA модел
Това проучване е проведено в съответствие с Ръководството за грижа и използване на лабораторни животни от Националния здравен институт. Протоколът е одобрен от Комитета по етика на опитите с животни от университета в Ксиамен. Процедурата за трансекция на преден кръстосан лигамент (ACLT) беше извършена, за да индуцира модел на ОА на коляното, както беше съобщено по-рано (Liu et al., 2016). След това новозеландските бели зайци (n = 24, възраст 5 месеца, тегло 2,5-3,0 kg) бяха разделени на две групи (бутафорни и ACLT). След анестезия и рутинна подготовка, на 18 зайци е извършена ACLT на левите колене, а на шест зайци е извършена фиктивна операция. На 3 седмици след ACLT, зайците бяха разделени на случаен принцип в три групи (шест зайци във всяка група) за вътреставно инжектиране на физиологичен разтвор, термогел или KGN термогел. На 6 седмици след фалшивата операция или 3 седмици след интраартикуларната инжекция, левите колена във всяка група се събират за хистологичен анализ и се събира синовиална течност за анализ на интерлевкин-1 (IL-6) и MMP-13, за оценка на възпалението на коленете.
In vitro култура на третирани с IL-1β хондроцити в KGN Thermogel
Клетъчната суспензия, съдържаща 5.0 × 10 5 третирани с IL-1β хондроцити, се смесва със 100.0 μL термогел или разтвор на KGN термогел при 4 ° С и след това се прехвърля в плака с 24 ямки. Смесеният разтвор на клетки-кополимер се инкубира при 37 ° С в продължение на 15 минути за желиране и първоначално прикрепване на клетката. 2,0 ml прясно DMEM, допълнено с 10% (V/V) FBS (HyClone ™, Thermo Scientific, Австралия), и 1% пеницилин и стрептомицин (Invitrogen, Carlsbad, CA, USA) бяха добавени.
За анализ на клетъчна пролиферация и анализ на съдържанието на ДНК, натовареният с клетки термогел се култивира в продължение на 1 седмица в DMEM. Културната среда се сменя на всеки 2 дни. Активността на пролиферация на клетки се измерва на ден 1, 5 и 7, като се използва тест за преброяване на клетки-8 (CCK-8; Dojindo Laboratories, Кумамото, Япония), съгласно инструкциите на производителите. Накратко, клетъчните култури (n = 3) бяха внимателно изплакнати с PBS и след това потопени в смесен разтвор от 10.0 μL реагент CCK-8 с 90.0 μL прясна среда при 37 ° С за 2 часа. Отчитанията на абсорбцията при 450 nm се наблюдават с помощта на четец за плаки.
Биохимичен анализ
За да разкрием ефекта на KGN термогела върху OA хондроцитите, измерихме ензима за разграждане на матрицата (MMP-13), компонента на извънклетъчната матрица [колаген тип 2 (COL-2) и гликозаминогликан (GAG)], секретиран от OA хондроцитите. Накратко, пробите се усвояват в предварително приготвен разтвор на папаин, съдържащ 0,5 М EDTA, 0,05 М цистеин хидрохлорид и 1,0 mg/ml папаин ензим (Sigma, Сейнт Луис, МО, САЩ) при 60 ° С за 12 часа. Аликвотните части от разграждането на пробата бяха използвани за измерване на ДНК и GAG, както беше съобщено по-рано (Wang et al., 2016a). Съдържанието на ДНК се измерва с помощта на флуоресцентен анализ. Общото съдържание на гликозаминогликан (GAG) беше определено с помощта на тест за свързване на багрило с 1,9-диметилметиленово синьо (DMMB; Sigma, St. Louis, MO, USA). Културната среда на третирани с IL-1β хондроцити се събира след 3 седмици култивиране в KGN термогел. Супернатантът се отделя от неразтворимите остатъци чрез центрофугиране при 12 000 rpm в продължение на 10 минути. Заешки MMP-13 и COL-2 ELISA комплекти (Cloud-Clone, Corp., Хюстън, Тексас, САЩ) бяха използвани за измерване на COL-2 и MMP-13 в съответствие с инструкциите на производителя. Концентрациите на GAG, COL-2 и MMP-13 се нормализират до съдържанието на ДНК, което се определя флуорометрично, използвайки оцветяване по Hoechst, както е описано по-рано (Wang et al., 2016a).
Анализи на генната експресия
За да оценим ефекта на KGN върху OA хондроцитите, ние измерихме експресиите на гени, свързани с артрит и гени, свързани с хрущяла. Експресирането на гени се открива чрез полимеразна верижна реакция в реално време (RT-PCR), както беше съобщено по-рано (Wang et al., 2016a). В предварително определени времеви моменти проби (n = 3) се хомогенизират в Trizol Reagent (Invitrogen, Carlsbad, CA, USA) с мелница за тъкани и РНК се екстрахира в съответствие с инструкциите на производителя. Концентрацията на изолирана РНК се определя чрез спектрофотометър ND-2000 (Nanodrop Technologies). Един микрограм РНК от всяка проба беше обратно транскрибиран в cDNA, използвайки MMLV Reverse kit (Promega, Madison, WI, USA), и RT-PCR анализът беше извършен, използвайки ABI 7300 PCR система в реално време (Applied Biosystems, Foster City, CA, САЩ) със SYBR Green PCR Master Mix (Тойобо, Осака, Япония). Относителната генна експресия се изразява чрез кратна разлика, която се изчислява като 2 ΔΔCT. Относителните промени в експресията в тези целеви гени се определят количествено чрез нормализиране на тяхната експресия към тази на домакинския ген глицералдехид-3-фосфат дехидрогеназа (GAPDH). PCR праймери за: колаген тип 1 (COL-1), колаген тип 2 (COL-2), агрекан (AGC), MMP-13 и GAPDH са изброени в таблица 1 .
маса 1
Последователности от праймери, използвани за PCR в реално време.
| COL-1 | TGGCAAGAACGGAGATGACG | GCACCATCCAAACCACTGAA |
| COL-2 | CCACGCTCAAGTCCCTCAAC | AGTCACCGCTCTTCCACTCG |
| AGC | CGTGGTCTGGACAGGTGCTA | GGTTGGGGTAGAGGTAGACG |
| MMP-13 | TTGACCACTCCAAGGACCCAG | GAGGATGCAGACGCCAGAAGA |
| GAPDH | CCATCACCATCTTCCAGGAG | GATGATGACCCTTTTGGCTC |
Col-1, тип 1 колаген; Col-2, тип 2 колаген; AGC, агрекан; MMP-13, матрична металопротеиназа 13; GAPDH, глицералдехид-3-фосфат дехидрогеназа.
Хистологичен анализ
След вътреставно инжектиране в продължение на 3 седмици всяка група зайци е евтанатизирана с предозиране на пентобарбитал натрий. Дисталната бедрена кост е резецирана за хистологична оценка. Няма ставна инфекция във всички колена. За да се оцени възпалението на колянните стави, се събира синовиална течност за анализ на интерлевкин-6 (IL-6) и MMP-13. След дисекция и фиксиране пробите се декалцифицират в 15% EDTA (рН 7.2 в PBS) с 5% параформалдехид при 4 ° С. След това декалцифицираните медиални кондили бяха изрязани, дехидратирани в степенувана етанолова серия и вградени в парафин. Секции бяха оцветени с H&E, TB (положителни за протеогликани) и имунохистохимични (IHC) оцветяване (положителни за COL-2). Протоколите за откриване на COL-2 са описани в горните раздели. Хистологичните секции бяха прегледани сляпо за количествена оценка на разрушаването на хрущяла с помощта на системата за оценяване на Osteoartritis Research Society (OARSI) (Pritzker et al., 2006).
Статистически анализ
In vitro поддържано освобождаване на KGN от KGN термогел (20,0 тегл.%) В PBS (рН 7,4) при 37 ° C (n = 3).
Клетъчна жизнеспособност и разпространение
След култивиране в среда за растеж в продължение на 72 часа, CCK анализът показа, че OA хондроцитите се пролиферират както в PLGA-PEG-PLGA термогел, така и в KGN термогел, показват повишена пролиферация в продължение на 7 дни in vitro култура (Фигура 2А). Въпреки това, броят на OA хондроцитите в термогел и KGN термогел на 7-ми ден не се различава значително в сравнение с този на 1-ви ден (p> 0,05). Забележително е, че броят на MSC в термогела KGN леко надмина този в термогела.
In vitro клетъчна пролиферация и производство на матриксни компоненти. (А) Анализът CCK-8 показа, че пролиферацията на третирани с IL-1β хондроцити в термогел или KGN термогел се увеличава с течение на времето (Б) Съдържанието на GAG се измерва чрез DMMB анализ, COL-2 и MMP-13 се определят чрез ELISA, след като третирани с IL-1β хондроцити се култивират в термогел или KGN термогел в продължение на 2 седмици (n = 3, * P Фигура 2В). Значително по-голямо количество GAG и COL-2 е открито в KGN термогел, отколкото в групата на термогел (p Фигура 3). По-голямо регулиране на специфичните за хиалин-хрущял гени COL-2 и AGC бяха открити в KGN термогелна система, отколкото при термогел без KGN (p Фигура 4). Лека дегенерация на хрущяла се наблюдава при фалшива група с хипертрофия и групиране на хондроцити. Важно е, че забелязахме отчетлив хондропротективен ефект на KGN термогел в гел група OA + KGN, който показва плитки вертикални цепнатини на повърхностния хрущял, локално изчерпване на протеогликани и частична загуба на COL-2 в ограничени зони на хрущяла. За сравнение, както OA, така и OA + термогел групите показаха тежки промени в OA, със значителна денудация и деформация на хрущяла, както и подчертано изчерпване на протеогликана и COL-2. Тези данни предполагат, че IA инжектирането на KGN показва противовъзпалителен ефект и насърчава регенерацията на хрущяла, в сравнение с IA инжектиране на физиологичен разтвор или термогел.
Хистологично оцветяване на ОА коляно, третирано с физиологичен разтвор (OA), термогел (OA + гел) и KGN термогел (OA + KGN гел) на 6 седмици след операция ACLT. (A – D) ТОЙ, (E – H) толуидиново синьо (TB) и (I Л) оцветяване с имунохистохимия (IHC) COL-2.
Метод ELISA, откриващ съдържанието на IL-6 и MMP-13 в синовиалната течност на всички групи на 6 седмици (n = 8, * p Фигура 6, ОАРСИ резултатите са значително по-ниски при фалшива група и група OA + KGN от тези на OA и OA + Гел групи (p 0,05). Тези данни предполагат продължаващо унищожаване на артрит и хрущял в групата OA и групата OA + гел и отшумяване на артрит и регенериран хрущял в артритни колена, лекувани с KGN термогел.
- Диагноза, лечение на артроза на коляното и свързаните с него фактори на прогресията, част II
- Диета с ниско съдържание на FODMAP за лечение на синдром на раздразнените черва
- Най-подходяща ли е веганска диета за лечение на кандида
- Лечението с LPG помага за отслабване; Вярно или мит »Как бързо да отслабнете
- Нискочестотната електрическа стимулация отслабва мускулната атрофия при ХБН - потенциално лечение